理論化学の溶液の性質で溶解度を学習しました。中でも大学入試や学校の定期テストで水和物の溶解度や、再結晶量について計算させる問題が登場します。苦手とする生徒が多いので、硫酸銅(Ⅱ)五水和物を例に計算の練習をしていきましょう。
再結晶量の計算パターン
まずは、水和物ではない通常の物質(無水塩)の再結晶量の計算パターンを練習しましょう。慣れるまでは、簡単にビーカーの図などを書くことで整理がつきます。また、溶液の量や析出量(再結晶量)は物質の量に比例しますので、比例式や分数式で解けますので、難しく考える必要はありません。
無水塩の再結晶量の計算問題
[問題]60℃の硝酸カリウム飽和溶液200gを40℃まで冷却すると、何gの結晶が析出するか。ただし、水100gに対する硝酸カリウムKNO3の溶解度は60℃で109、40℃で64である。
手順1「図に書いてみる」
解き方がわかる場合には省いてもらって結構ですが、どこから手をつければよいかわからない場合は、下のような図を書きイメージを膨らませてください。ヒントとして溶解度(水100gに溶ける量)が与えられますので、そちらの図もあわせて書きます。
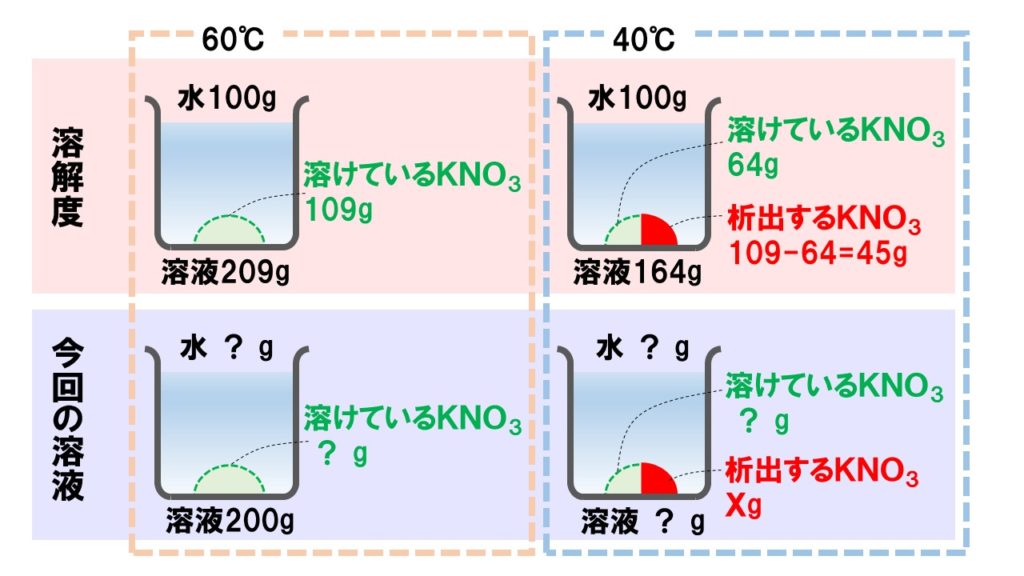
手順2「比例式を立てる」
図でイメージがつかめたなら、次は立式を行います。分数の式を立てても構いませんし、比例式を立てても構いません。このとき、求めたい量をxやyなどの文字で表し、各温度で溶液、溶媒、溶質、結晶量などそろえて立てるようにしてください。
析出するKNO3の量をXgとすると、

これを計算すると、X≒43g
水和物の再結晶量の計算問題
[問題]60℃の硫酸銅(Ⅱ)五水和物の飽和水溶液280gを30℃まで冷却すると、何gの結晶が析出するか。ただし、硫酸銅(Ⅱ)の溶解度は60℃で40、30℃で25である。
手順1「式量を按分しておく」
硫酸銅(Ⅱ)五水和物CuSO4・5H2Oは、硫酸銅(Ⅱ)CuSO4の無水物に水分子H2Oが5分子くっついたものです。水に溶けると、この5H2O部分は溶媒の水と一緒になってしまいますが、結晶として析出する場合には5分子の水もくっついて析出します。
硫酸銅(Ⅱ)五水和物CuSO4・5H2Oが水に溶けた場合、溶液中の溶質は硫酸銅(Ⅱ)CuSO4の無水物だけの量にしなくてはなりません。なので、CuSO4・5H2Oの式量とCuSO4、5H2Oの式量や分子量を使って按分計算をする必要があります。
- CuSO4・5H2Oの式量:250
- CuSO4の式量:160
- 5H2Oの分子量:90
按分計算は次のようにします。例えば、XgのCuSO4・5H2Oが溶けている場合、溶質になっているのはCuSO4だけの部分ですので、溶質の量は、
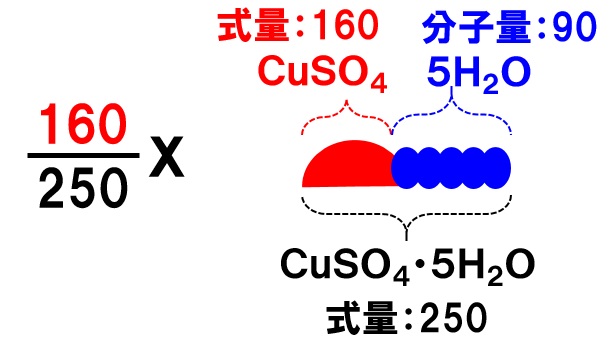
と表すことができます。
手順2「図を描いてみる」
溶質を文字で表すことができたら、次はイメージを掴むために図に書き表してみます。60℃の飽和溶液に何gのCuSO4が溶けているかわからないのでXgとし、析出するCuSO4・5H2OをYgとします。
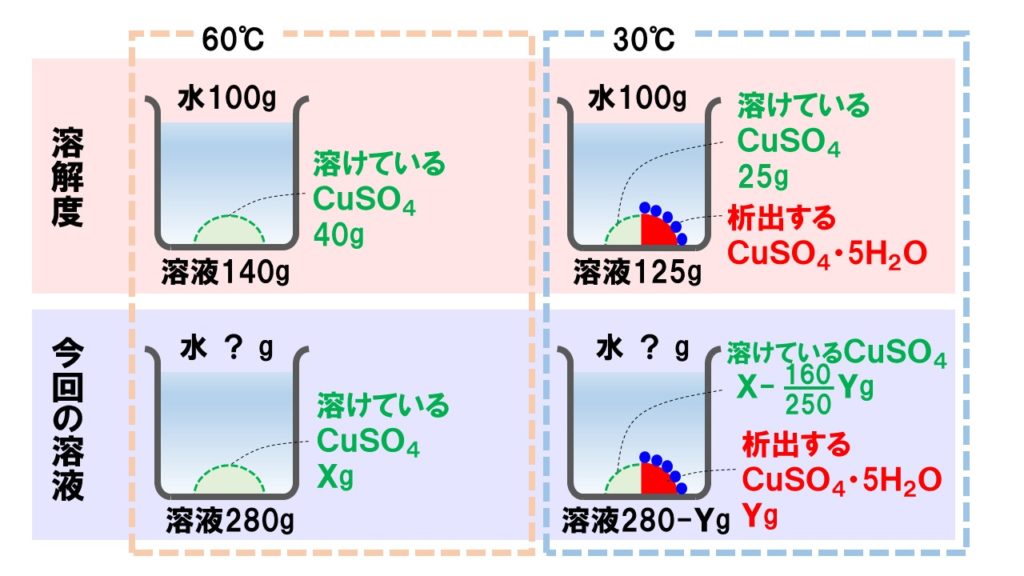
手順3「比例式を立てる」
イメージがつかめたら次に分数の式や比例式を立てます。この問題の場合は、まずXを計算します。60℃の飽和溶液中に何gのCuSO4が溶けているのかを求めます。

溶質の量X=80g
次に、冷却した後に何gの結晶が析出するかを求めます。溶解度(水100g)の場合、冷却後の溶液中に25gの溶質CuSO4が溶けていることがわかるので、それで式を立てます。

これを解くと、Y≒55g
まとめ
溶解度をうまく利用して、立式することが重要ですね。その際、溶液や溶媒、溶質、そして温度をそろえることを意識してください。
また、按分計算の方法も水和物の場合必要になりますので、これも練習しておきましょう。ここは、2度、3度演習しないと定着しませんので、何回も繰り返し計算して叩き込みましょう。


コメント