【高校化学基礎】物質の構成粒子のポイントです。
1.物質の構成粒子
第1章は物質の構成粒子に関する内容を学習します。ここは文系理系問わず、化学基礎から学習する内容です。特に原子やイオンに関する知識はマスターしておかないと、これから先何もわからなくなってしまいます。
重要問題集を手にしている時点で、この点は大丈夫だと思いますが、穴がないようにしっかりと復習しておきましょう。
物質の構成粒子で取り扱う単元
- 物質の構成
- 元素と単体
- 混合物の分離・精製
- 同素体
- 原子の構造
- 同位体
- 電子配置
- イオン半径
- イオン化エネルギー
- 電子親和力
1.物質の構成
元素は現在約120種類存在します。原子番号113番のNh(ニホニウム)は2016年11月に正式に名称が決定しました。
空気の組成
- 窒素 78%
- 酸素 21%
- アルゴン 0.93%
- 二酸化炭素 0.035%
第3位がアルゴンだということもしっかりと覚えておきましょう。
物質の分類
| 物質 | 混合物 | 空気、海水、石油、塩酸、食塩水、黄銅など | |
| 純物質 | 単体 | H2、O2、C、Fe、Cuなど | |
| 化合物 | H2O、CO2、NH3、NaCl、CuOなど | ||
水溶液は全て混合物になることに注意が必要です。黄銅や青銅、ジュラルミンのような合金類も混合物になります。純物質は1種類の元素からなる単体と2種類以上の元素からなる化合物に分けられますが、化学式に直すことで分類が可能です。
2.混合物の分離
分離とは、2種類以上の物質が混ざっている混合物を純物質に分ける操作をいいます。混合物の分離方法には以下のようなものを覚えておけば十分でしょう。
- 蒸留
液体を加熱して生じた気体を冷却することで純粋な液体を得る分離方法
例)食塩水から水を得る - 抽出
混合物から特定の溶媒に溶け物質のみをとり出す分離方法
例)植物の葉からクロロフィルをとり出す - 分留
沸点の違う液体の混合物を蒸留によって各成分に分離すること
例)液体空気、石油 - クロマトグラフィー
物質の紙などへの吸着力の違いを利用して、移動速度の差によって分離すること
例)ペーパークロマトグラフィー(光合成色素の分離実験) - 再結晶
温度による溶解度の差を利用して、結晶として物質をとり出す分離方法
例)塩化ナトリウムと硝酸カリウム - ろ過
水溶性の物質と水に溶けない物質などを粒子の大きさで分離する操作
例)石灰水にできた白濁を取り除く - 昇華
昇華(固体↔気体)の状態変化を利用し、混合物を分離する操作
例)ヨウ素、ナフタレン、ドライアイス - 蒸発
溶液中から溶媒を蒸発させ固体の溶質を得る方法
例)食塩水から食塩をとり出す
3.同素体
「同素体はスコップ(SCOP)で掘れ!」で大丈夫でしょう。この4つの元素からできている物質にしか同素体は存在しません。同位体と混同しないようにしましょう。
- S(硫黄)
ゴム状硫黄Sx、単斜硫黄S8、斜方硫黄S8 - C(炭素)
黒鉛(グラファイト)、ダイヤモンド、フラーレンC60、カーボンナノチューブ - O(酸素)
酸素O2、オゾンO3 - P(リン)
赤リンPx、黄リンP4
ゴム状硫黄は鎖状分子、単斜・斜方硫黄は環状分子になっています。酸素は2原子分子なので直線構造、オゾンは3原子分子で折れ線構造になります。赤リンは赤褐色の物質で無毒。マッチの摩擦面に使われています。黄リンは淡黄色で猛毒、空気中で自然発火するので水中に保存します。
このように同素体は、おなじ元素からできている単体ですが、性質がまったく違うものになります。
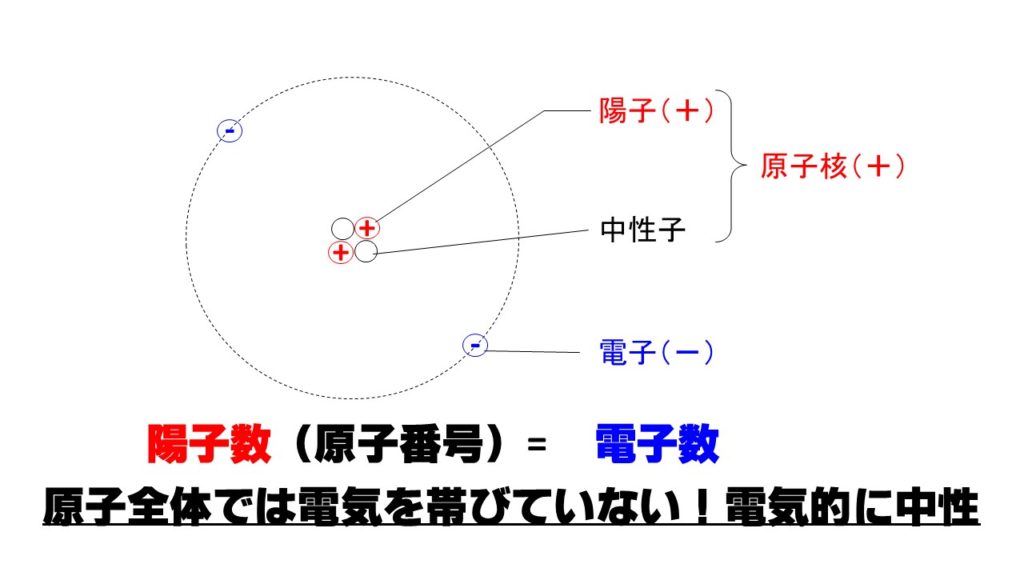
4.原子の構造と同位体
原子の構造は、イオンを勉強する大前提です。粒子の性質と大きさや質量などポイントとなることをしっかりと覚えましょう。
陽子、中性子、電子の質量比
原子核を構成する陽子と中性子と比べて、その周りの電子殻を飛んでいる電子は非常に軽くなります。
陽子:中性子:電子=1:1:1/1840
電子は非常に軽いので、原子の質量の目安となる質量数には関係がありません。
質量数=陽子数+中性子数
同位体(アイソトープ)
同位体(アイソトープ)とは、原子番号が同じで、質量数の異なる原子のことです。原子番号が同じということは陽子の数は一緒です。しかし、質量数が違うということは「中性子数」の数が違うということですね。
同位体どうしは、質量数が異なりますが、化学的性質はほとんど変わりません。
放射性同位体(ラジオアイソトープ)
同位体の中には、原子核が不安定で、放射線とよばれる粒子や電磁波を出しながら崩壊していくものがあります。このような同位体を放射性同位体(ラジオアイソトープ)といいます。
放射線にはα線、β線、γ線がありますが、β線を出す放射性同位体として炭素14Cを覚えておいてください。遺跡や化石などの年代測定に利用されています。
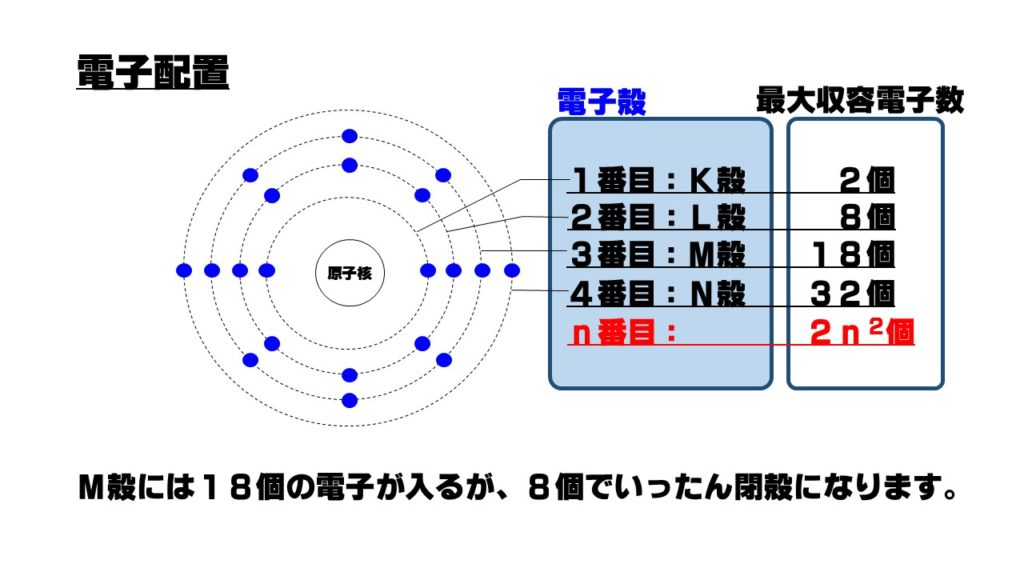
5.電子配置
電子は、原子核の周りをいくつかの層に分かれて運動しています。この電子が運動している層を電子殻といいます。電子殻は原子核から近い順位に、K殻、L殻、M殻、N殻…と続きます。この電子殻への電子の入り方を電子配置といい、各電子殻に規則的に電子が収容されていきます。
このとき、最も外側にある電子殻に収容されている電子を最外殻電子といい、原子の化学的な性質を決定づけます。各電子殻に最大に収容できる電子が満たされると、その電子殻は閉殻となり、その次の外側の電子殻に電子が収容されるようになります。
このように最外殻が閉殻となったり、M殻以上の電子殻では最外殻電子数が8個(オクテット)の時は、その電子配置は非常に安定した状態になります。この電子配置を希ガス型の電子配置といいます。
6.電子配置とイオンの半径
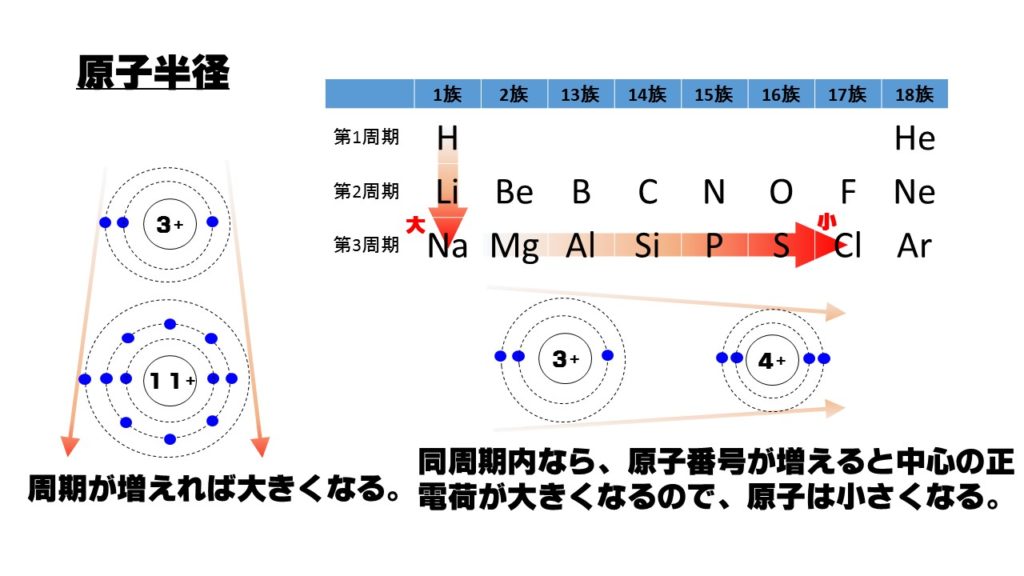
原子の大きさを決めるものは電子殻です。電子殻が大きければ、その原子の大きさも大きいことになります。
- 周期が増える、つまり、電子殻が多ければ多いほど原子は大きくなっていきます。
- 同周期内では、原子番号が増えると、原子核の正電荷が大きくなり、電子を中心に引きつけるので、原子の大きさは小さくなります。
イオンの場合も考え方は同じですが、電子を失って希ガス型の電子配置を取っていますので、実際に原子やイオンの電子配置を書きながら考えてみてください。
4Be2+、8O2-、9F–、11Na+、12Mg2+、16S2-
イオンなので、どの希ガスの電子配置を取っているか確認する。
- 16S2-はAr型の電子配置なので、一番大きい
- 8O2-、9F–、11Na+、12Mg2+はNe型の電子配置なので、その次に大きい
- 4Be2+はHe型の電子配置なので、一番小さい
同じ希ガスの電子配置を取っている場合は、原子核の正電荷の大きさでイオンの大きさを考える。原子核の正電荷が大きいほど(原子番号が大きいほど)原子は中心に引きつけられ小さくなります。
- 8O2->9F–>11Na+>12Mg2+
7.原子の電子配置
| 元素 | 電子殻の電子数 | ||
| K | L | M | |
| (ア) | 2 | ||
| (イ) | 2 | 1 | |
| (ウ) | 2 | 4 | |
| (エ) | 2 | 8 | 1 |
| (オ) | 2 | 8 | 7 |
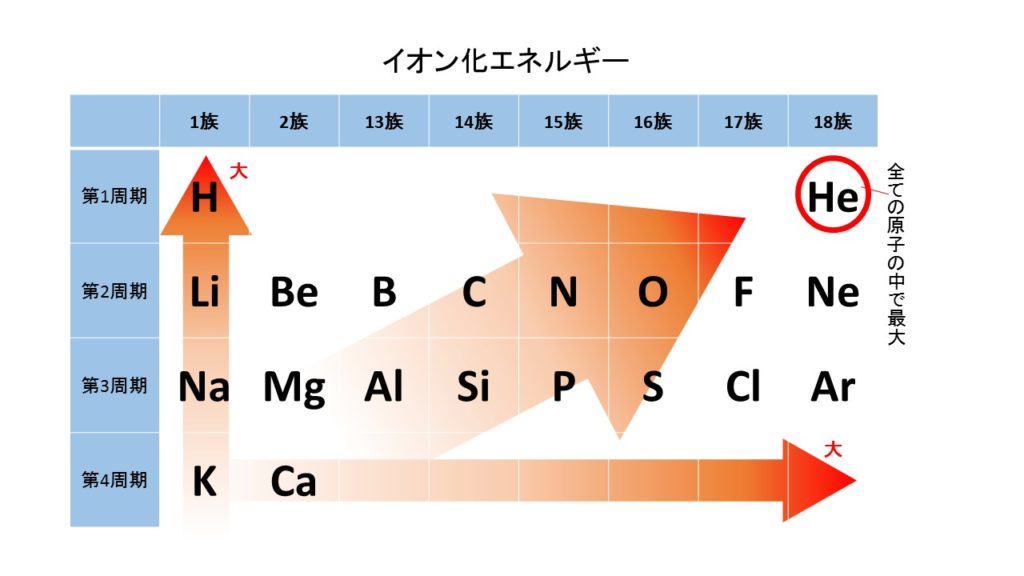
第1イオン化エネルギー
第1イオン化エネルギーとは、原子が電子を放出して、1価の陽イオンになるのに必要なエネルギーのことです。周期表の右上の原子ほど大きく陽イオンになりにくく、左下の原子ほど小さく陽イオンになりやすくなっています。
表の(ア)~(オ)の中で最大になるのは(ア)のHeになります。
同族内の原子半径
同族内、つまり周期表の縦の並びの中で原子半径を比較すると、周期表の下の方にある原子が電子殻が多く、その分原子半径は大きくなります。
表の中で同族の原子は、価電子がともに1である(イ)と(エ)になります。(イ)は原子番号3番のLi原子で、電子殻はL殻まで。(エ)は原子番号11番のNa原子で、電子殻はM殻まであり、小さい原子はLiになります。
電子親和力
電子親和力とは、原子が電子を受け入れて、1価の陰イオンになるときに放出されるエネルギーを言います。希ガスを除く周期表の右側の原子であるハロゲン(17族)で最大となり、最も陰イオンになりやすくなっています。
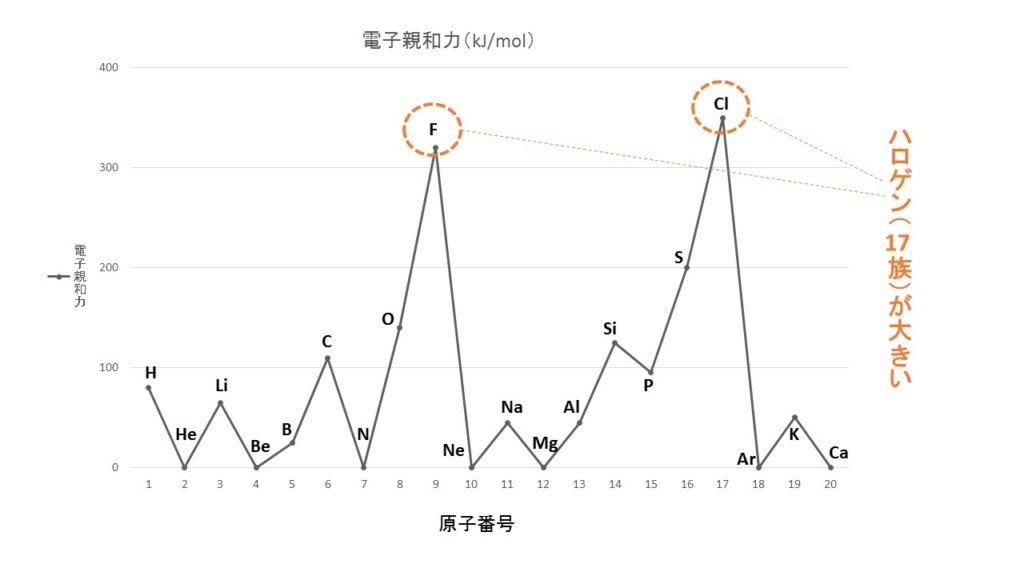
したがって、表の中では最外殻に価電子が7個の(オ)がハロゲンであり、最も陰イオンになりやすくなっています。
希ガスの化学的性質
希ガスは18族の原子で、最外殻が電子で満タンになり閉殻している原子です。このため、化学結合に関係する価電子が0となり、他の原子と結合しない安定した状態にあります。
このため希ガスは他の原子と結合せずに、一つの原子だけで単原子分子を形成しています。希ガスはすべて気体になります。
表の中で(ア)のHeは、K殻に2個電子が収容されており閉殻構造になっています。
記述のポイントは、
- 最外殻が閉殻している→安定な電子配置になっている
- 最外殻が閉殻している→結合に必要な価電子が0となっている
などのようにしっかりとキーワードを盛り込みましょう。
質量数
質量数とは原子の質量みたいなものです。質量数は元素記号の左上に書かれている数字で、次のようにして求めることができます。
質量数=陽子数+中性子数
(ウ)は電子総数が6個なので、陽子も6個で原子番号は6番になります。質量数が13なので、
質量数13-陽子数6=中性子数7
化合物の組成式
組成式とは、イオン結合や金属結合などの結合に関係する原子の個数の比を書き表したものです。組成式をつくる際は、その化合物が電気的に中性になるように、陽イオンのと陰イオンの個数を調節します。
例えば、AlとOでイオン結合している場合の組成式は、Al3+とO2-のイオンで結合しますので、電気的に中性にするには が2個、が3個必要になります。したがって化合物の組成式はAl2O3となるのです。
(エ)のNaと(オ)のClでイオン結合するときは、Na+とCl-での結合になりますので、1:1の組成比で結合しています。したがって組成式はNaClとなります。


コメント