共通テスト試験の化学や化学基礎で必ず出題される「酸化・還元」。ここではどの物質が酸化剤または還元剤としてはたらくのかを覚える必要があります。また、イオン反応式も自分でつくれるようになっておかなくてはなりません。今日は絶対暗記の酸化剤・還元剤、それらを使ったイオン反応式のつくり方を学習します。
酸化剤・還元剤とは
酸化剤と還元剤を紹介する前に、酸化・還元とはどのような反応だったのかを簡単に復習します。定義がいくつかありますので確認しましょう。
| 酸化 | 還元 | |
| 酸素 | 酸素と化合する | 酸素を奪われる |
| 水素 | 水素を奪われる | 水素と化合する |
| 電子 | 電子を失う | 電子を得る |
| 酸化数 | 増加する | 減少する |
様々な定義がありますが、酸化数の考え方がわかっていれば、すべて覚える必要は無く、酸化数の増減で酸化反応か還元反応なのかを判断することができます。
酸化剤とは
酸化剤とは、電子を受けとり相手の物質を酸化する物質のことです。自分自身は電子e–を受けとるので還元されることになります。次の化学反応式を見てください。
![]()
下線の塩化水素HClは酸化剤でしょうか?それとも還元剤でしょうか?このとき下線部の原子の酸化数の変化を見れば酸化剤か還元剤かが判明します。
下線の水素Hの酸化数は+1でしたね。これが右辺の水素H₂に変化すると、酸化数は0に変化します。単体の酸化数は0になるからです。
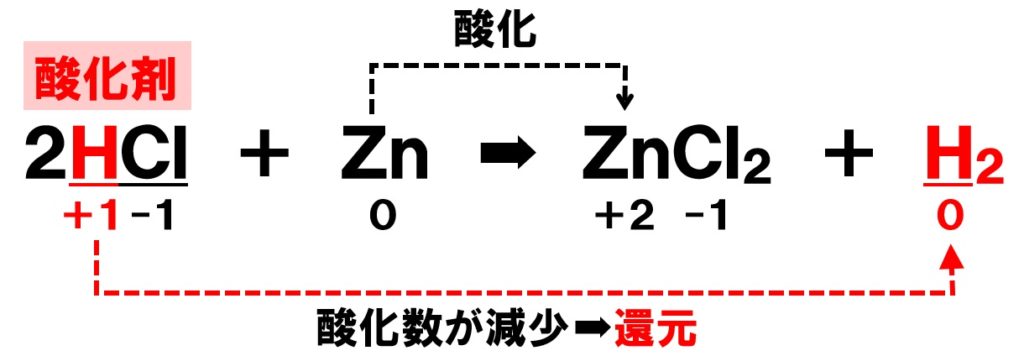
このとき、塩化水素HClは自らが還元され、相手の亜鉛Znを酸化していることがわかります。このように、自らは還元され、相手を酸化するような物質を酸化剤といいます。
還元剤とは
還元剤とは、電子を失い相手の物質を還元する物質のことです。自分自身は電子e-を失うので酸化されることになります。次の化学反応式を見てください。
![]()
下線部のカリウムKは酸化剤でしょうか?それとも還元剤でしょうか?ここでも酸化数の増減を見ていきます。単体のKの酸化数は0です。右辺のKOHのKの酸化数は+1になるので、カリウムK自身は酸化されたことになります。
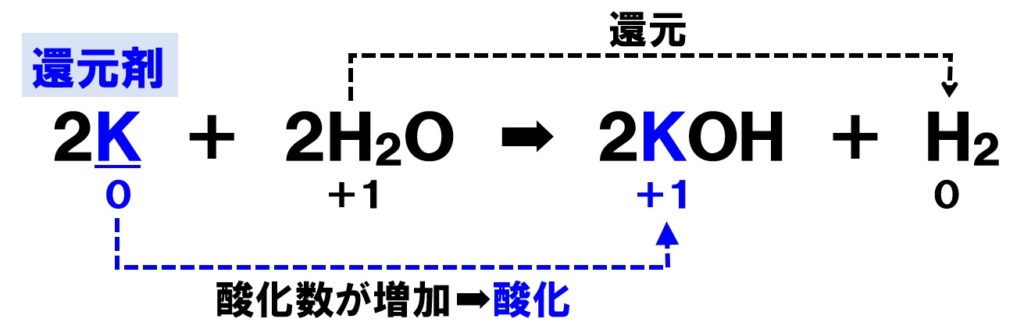
カリウムKは自らは酸化され、相手のH₂Oを還元しているので還元剤になるということです。
酸化剤と還元剤は暗記するの?
酸化・還元で登場する酸化剤と還元剤は多岐にわたります。これを覚える必要があるのかという質問をよく受けますが、はっきりいってよく登場する酸化剤と還元剤は覚える必要があります。大変でしょうが頑張って覚えるようにしましょう。
覚えるべき酸化剤
式全体を暗記する必要はありません。どの物質やイオンが酸化剤で、反応後何という物質になるのかを覚えてください。
- 過マンガン酸イオンMnO₄⁻
MnO₄⁻+5e⁻+8H⁺→Mn²⁺+4H₂O - 二クロム酸イオンCr₂O₇²⁻
Cr₂O₇²⁻+6e⁻+14H⁺→2Cr³⁺+7H₂O - 濃硝酸HNO₃
HNO₃+e⁻+H⁺→NO₂+H₂O - 希硝酸HNO₃
HNO₃+3e⁻+3H⁺→NO+2H₂O - (熱)濃硫酸H₂SO₄
H₂SO₄+2e⁻+2H⁺→SO₂+2H₂O - ハロゲンCl₂
Cl₂+2e⁻→2Cl⁻ - 二酸化硫黄SO₂
SO₂+4e⁻+4H⁺→S+2H₂O - 過酸化水素H₂O₂
H₂O₂+2e⁻+2H⁺→2H₂O
覚えるべき還元剤
還元剤も式全体を暗記する必要はありません。どの物質やイオンが還元剤で、反応後何という物質になるのかを覚えてください。
- シュウ酸H₂C₂O₄
H₂C₂O₄→2CO₂+2e⁻+2H⁺ - 硫化水素H₂S
H₂S→S+2e⁻+2H⁺ - 二酸化硫黄SO₂
SO₂+2H₂O→SO₄²⁻+2e⁻+4H⁺ - 過酸化水素H₂O₂
H₂O₂→O₂+2e⁻+2H⁺
【問題】酸化剤・還元剤の練習問題
(1)CuO+H₂ → Cu+H₂O
(2)Fe₂O₃+2Al → 2Fe+Al₂O₃
(3)2KI+H₂O₂ → 2KOH+I₂
(4)SO₂+2H₂S → 3S+2H₂O
解答(1)CuO (2)Fe₂O₃(3)H₂O₂ (4)SO₂

コメント