理論化学の中でも質問が多い、水素イオン濃度とpH(水素イオン指数)について解説します。ここでは、数学嫌いにとって厄介なlogの計算が登場しますが、いくつかのポイントを押さえるだけで簡単にlogを使いこなせるようになりpH計算ができるようになります。
水素イオン濃度とpH まずはじめに
水溶液の酸性や塩基性の強さを表す尺度としてpH(水素イオン指数)を使いました。pHは数値が0~14まで存在し、pHの値が7のとき中性で、7より値が小さいほど酸性が強く、7より値が大きいと塩基性が強くなります。
水素イオン濃度からpHを求める
水素イオン濃度[H+]からpHを求めるには、水素イオン濃度を1.0×10-2のような指数の形にし、指数を正の数にして読めばいいだけです。pH=2。
水素イオン濃度[H+]=1.0×10-nmol/L
水素イオン指数 pH=n
これをlogを使った公式で表すと次のようになります。
pH=-log10[H+]
pH=-log1010-n
pH=n
難しく感じますが、右肩の指数を正の数にして答えるだけでいいのです。
pH計算のlogの使い方
簡単なものだとすぐに答えが出ますが、複雑なものになるとlogの公式を使いこなさないといけなくなります。下の公式を覚えておけば大丈夫です。
- log10A×B=log10A+log10B
- log10A÷B=log10A-log10B
- log1010n=n
掛け算は足し算に、割り算(分数)は引き算になる程度の理解で十分です。
水のイオン積Kw
水のイオン積Kwとは、温度が25℃の場合、水素イオン濃度[H+]と水酸化物イオン濃度[OHー]の積が1.0×10ー14で一定になるというルールみたいなものです。
水溶液が酸性であろうが、中性であろうが、塩基性であろうが必ず1.0×10ー14で一定になります。ということは、水のイオン積Kwを使えば、水酸化物イオン濃度[OHー]から水素イオン濃度[H+]を求めることができ、pHまで計算することができるようになります。
[H+]×[OH-]=1.0×10-14
例えば[OH-]が1.0×10-3だったとき、pHは次のように計算できます。
[H+]×1.0×10-3=1.0×10-14
[H+]=1.0×10-11
pH=-log1010-11
pH=11
この他にも、下記のpHとpOHの関係を使っても大丈夫です。
pH+pOH=14
[OH-]=1.0×10-3
pOH=-log1010-3
pOH=3
pH+3=14
pH=11
慣れれば、問題なく計算できるようになります。ここで、pHと水素イオン濃度、水酸化物イオン濃度の関係を図で表してみます。
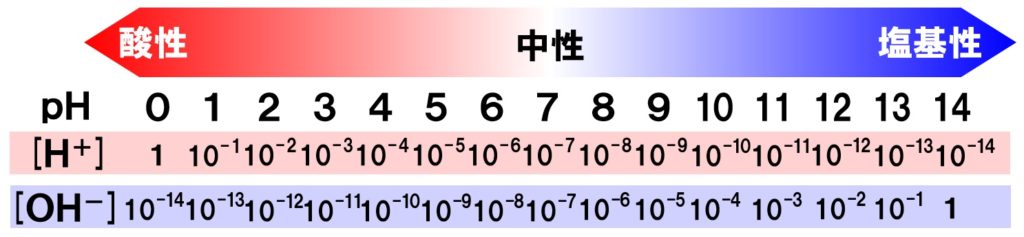
pH計算特訓
水素イオン濃度や水酸化物イオン濃度からpH(水素イオン指数)を求める練習を行います。簡単な問題から少しずつ難しくしています。しかし、やり方をマスターすれば、簡単に計算できますので、あきらめずに頑張ってください。
pH計算(1価の強酸)
[問題]0.1mol/Lの塩酸のpHを求めよ。
塩酸が電離しているようすを式で表すと、
HCl→H++Cl-
1価の酸である。
塩化水素は強酸なので、電離度α=1
[H+]=0.1mol/L×1価×1=1.0×10-1
-log10[H+]の公式に当てはめると、
pH=-log1010-1
pH=1
pH計算(2価の強酸)
[問題]5.0×10-3mol/Lの硫酸のpHを求めよ。
硫酸が電離しているようすを式で表すと、
H2SO4→2H++SO42-
2価の酸である。
硫酸は強酸なので、電離度α=1
[H+]=5.0×10-3mol/L×2価×1=1.0×10-2
-log10[H+]の公式に当てはめると、
pH=-log1010-2
pH=2
pH計算(1価の強塩基)
[問題]0.1mol/Lの水酸化ナトリウム水溶液のpHを求めよ。
水酸化ナトリウムが電離しているようすを式で表すと、
NaOH→Na++OH-
1価の塩基である。
水酸化ナトリウム水は強塩基なので、電離度α=1
[OH-]=0.1mol/L×1価×1=1.0×10-1
水のイオン積Kwを用いて、
[H+]×1.0×10-1=1.0×10-14
[H+]=1.0×10-13
-log10[H+]の公式に当てはめると、
pH=-log1010-13
pH=13
pH計算(1価の弱酸)
[問題]0.10mol/Lの酢酸のpHを求めよ。ただし、電離度α=0.010とする。
酢酸が電離しているようすを式で表すと、
CH3COOH⇄CH3COO-+H+
1価の酸である。
弱酸である酢酸の電離度α=0.010なので、
[H+]=0.10mol/L×1価×0.010=1.0×10-3
-log10[H+]の公式に当てはめると、
pH=-log1010-3
pH=3
pH計算(応用1)
[問題]0.050mol/Lの塩酸のpHを求めよ。ただし、log102=0.30とする。
塩酸なので、価数1、電離度α=1
[H+]=0.050mol/L
pH=-log100.050=-log10(0.1÷2)
=-log10(10-1÷2)
=-(log1010-1-log102)
=1+0.30
=1.3
pH計算(応用2)
[問題]1.0×10-4mol/Lの硫酸のpHを求めよ。ただし、log102=0.30とする。
硫酸なので、価数2、電離度α=1
[H+]=1.0×10-4mol/L×2価×1=2.0×10-4mol/L
pH=-log102.0×10-4=-log10(2×10-4)
=-(log102+log1010-4)
=-0.3+4
=3.7
pH計算(応用3)
[問題]0.10mol/Lのアンモニア水のpHを求めよ。ただし、電離度α=0.02とし、log102=0.30とする。
アンモニア水の価数は1、弱塩基で電離度は0.02
[OH-]=0.10mol/L×1価×0.02=2.0×10-3
pOH=-log102.0×10-3=-log10(2×10-3)
=-(log102+log1010-3)
=-0.3+3
=2.7
pH+pOH=14より
pH=14-2.7=11.3
ここまでpH計算ができるのであれば、ほぼ大丈夫でしょう。あとは実戦問題で使えるように問題演習あるのみです。頑張れ!

コメント