【高校化学基礎】原子・イオンのポイントです。
物質の構成粒子
第1章は、物質を構成する粒子である原子やイオンに関係する内容となっています。化学の基礎となる重要な単元です。ここはひとつの漏れも無いようにしっかりと学習していきましょう。
8.中性数と電子数
原子の中の粒子数に関する問題です。ここで陽子数や中性子数、電子数についてまとめておきます。
原子:原子番号=陽子数=電子数
イオン:原子番号(陽子数)ー電子数=イオンの価数
原子・イオン:質量数=陽子数+中性子数
水酸化物イオンOH–の電子の総数
水酸化物イオンを構成する原子OとHの電子の数をまず数えます。酸素原子Oは原子番号8番ですので陽子の数が8個。したがって電子の数も8個。水素原子Hは原子番号1番で、陽子数が1、電子数も1。次に、1価の陰イオンですので、電子総数が陽子総数よりも1つ多くなっています。
酸素原子の電子数8+水素原子の電子数1+1価の陰イオン=電子総数10
同位体と水分子の中性子の総数
水分子H2Oは、水素原子Hが2つと酸素原子Oが1つ組み合わさってできている分子です。水素原子には中性子の数が0個の1Hと、中性子の数が1個の2Hが同位体として存在し、酸素原子には中性子が8個の16O、中性子の数が9個の17O、中性子の数が10個の18Oが存在します。
これらの同位体がある原子でつくられる水分子は次の9通りが考えられます。
- 1H1H16O
- 1H2H16O
- 2H2H16O
- 1H1H17O
- 1H2H17O
- 2H2H17O
- 1H1H18O
- 1H2H18O
- 2H2H18O
それぞれの中性子総数は次のようになります。
- 1H1H16O 0+0+8=8
- 1H2H16O 0+1+8=9
- 2H2H16O 1+1+8=10
- 1H1H17O 0+0+9=9
- 1H2H17O 0+1+9=10
- 2H2H17O 1+1+9=11
- 1H1H18O 0+0+10=10
- 1H2H18O 0+1+10=11
- 2H2H18O 1+1+10=12
イオンの電子総数から原子の中性子数を求める
鉄(Ⅲ)イオンFe3+の電子総数23は、鉄原子の電子総数よりも3個少ない状態です。したがって鉄原子の電子総数は26となり、電子数と陽子数が等しいことから陽子数(原子番号)は26となります。質量数が56の鉄原子ですので中性子数は次のように計算します。
質量数56=陽子数26+中性子数x
したがって中性子数は30個となります。
9.原子の電子配置
原子の電子配置に関する問題。電子配置を見て化学的性質が答えられるようになることが大切です。
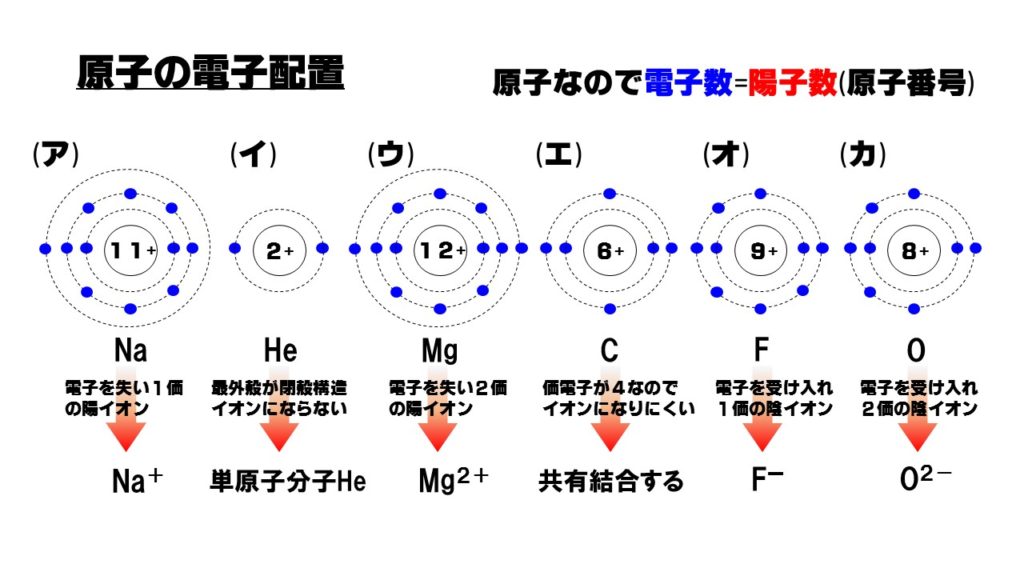
イオン化エネルギーが最も小さい原子
イオン化エネルギーとは、原子が電子を失い1価の陽イオンになるのに必要なエネルギーでした。イオン化エネルギーが小さい原子ほど陽イオンになりやすく、大きい原子ほど陽イオンになりにくかったですね。
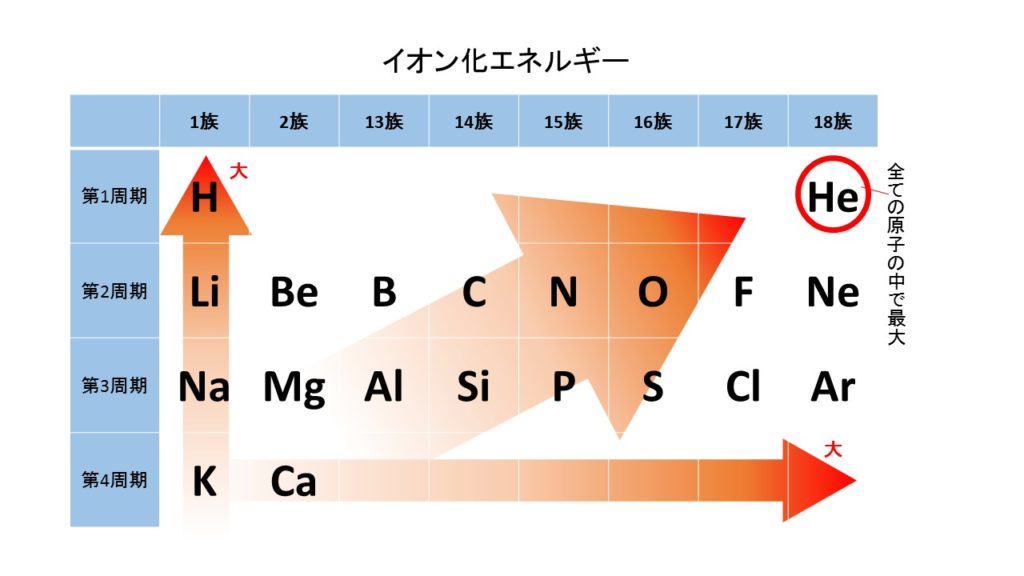
周期表の場合は、左下に登場する原子ほどイオン化エネルギーが小さく陽イオンになりやすくなっています。したがって上の図の中で最もイオン化エネルギーが小さく陽イオンになりやすい原子は(ア)となります。
二価の陽イオンになりやすい原子
陽イオンの中でも電子を2個放出し、電子の数が陽子の数よりも2個少なくなっているイオンが2価の陽イオンです。価電子が2の原子、周期表では2族原子が2価の陽イオンになりやすいです。また、典型元素ではなく遷移元素である3族~11族も価電子が2個の原子が多いので2価の陽イオンになりやすい原子だ言えます。
上の図の中で価電子が2個の原子は(ウ)のマグネシウム原子Mgです。
単原子イオンになりにくい原子
単原子イオンとは、原子1個で陽イオンや陰イオンになっているもので、多原子イオンとはいくつかの原子の塊(原子団)でイオンを形成しているものになります。
単原子イオンになりにくい原子は、希ガス(18族)と周期表で言うと真ん中の列当たりの原子、14族や15族の原子がイオンになりにくくなっています。
したがって、上の図で単原子イオンになりにくいのは、希ガスであるHe(イ)、14族で価電子が4個の炭素C(エ)となります。
水素と酸素からなる多原子イオン
水素原子Hと酸素原子Oからなる他原子イオンは次の2つを覚えておいてください。
- 水酸化物イオンOH-
- オキソニウムイオンH3O+
最外殻電子と価電子
最外殻電子とは、その名の通り最外殻にある電子で、最外殻にある電子を数えることで分かります。周期表でいうとHeを除いて、属番号の下一桁と一致します。
価電子とは、電子の中で化学結合に関係する電子のことをいいます。希ガスでは最外殻が満タンとなり閉殻していますので、化学結合に使われる電子がない状態です。したがって、希ガスの価電子は0となります。
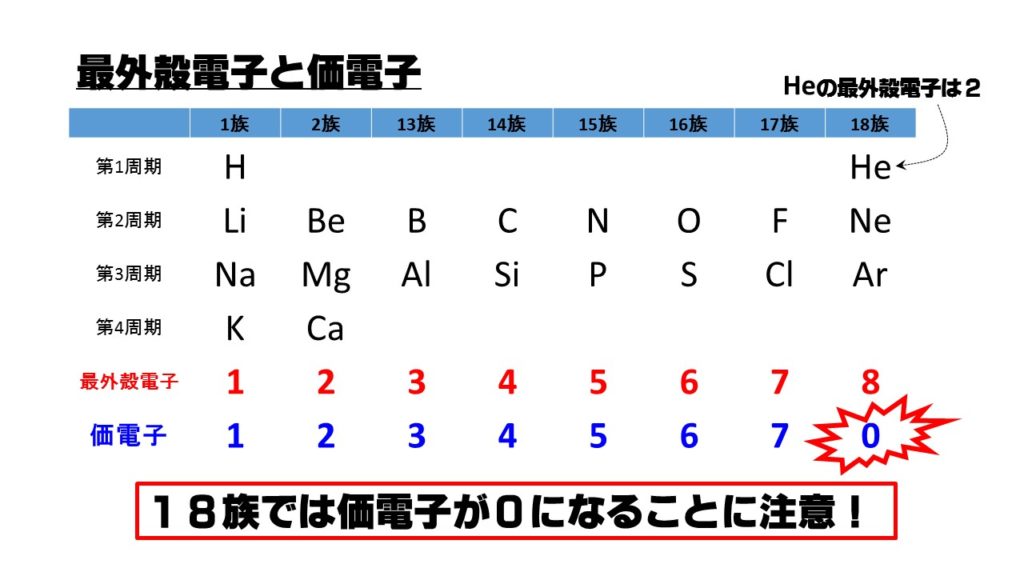
上の図の中で価電子数と最外殻電子数が一致しないのは希ガスであるHe(イ)になります。
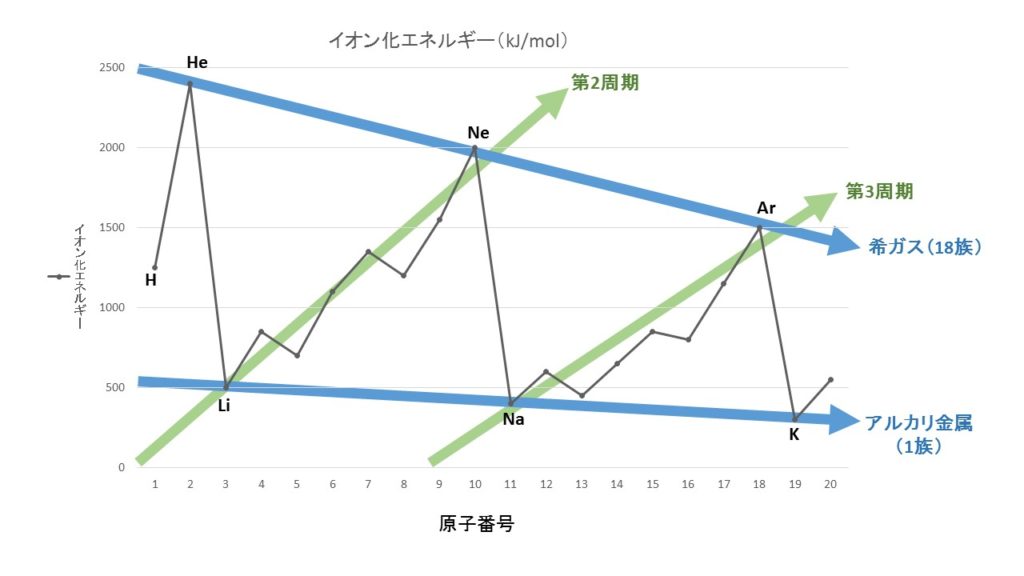
10.電子親和力とイオン化エネルギー
イオン化エネルギーと電子親和力に関する問題は超頻出です。定義をしっかりとマスターすると同時に、グラフからの傾向もマスターしてください。
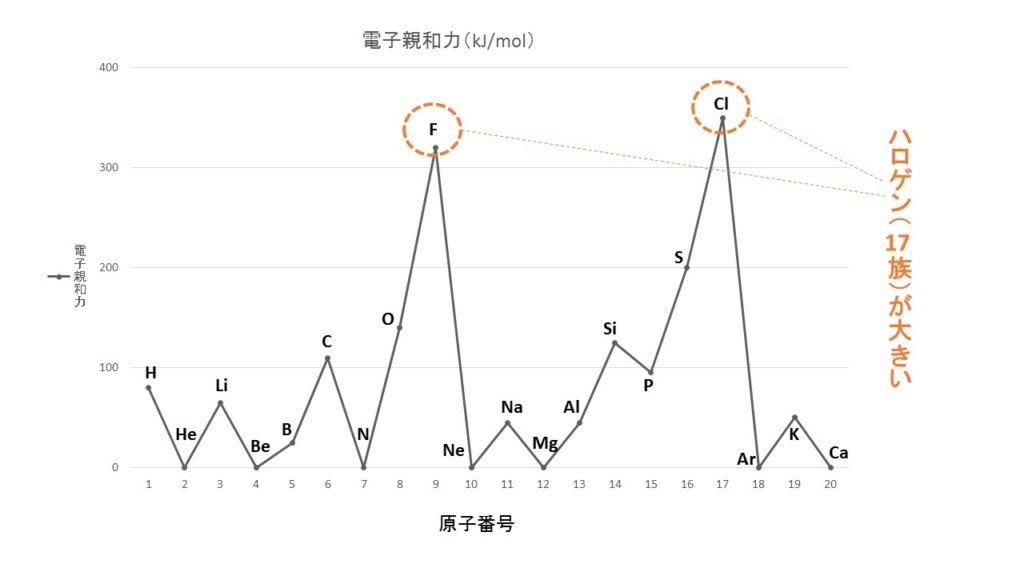
電子親和力
電子親和力とは、原子が電子を1個受け取って、1価の陰イオンになるときに放出されるエネルギーです。電子親和力が大きな原子ほど、陰イオンになりやすく、電子親和力が小さな原子ほど陰イオンになりにくいです。
電子親和力は、ハロゲン(17族)が大きく、最も陰イオンになりやすいことを覚えておけば大丈夫でしょう。
イオン化エネルギー
イオン化エネルギーとは、原子から電子を1個とり去って、1価の陽イオンにするのに必要なエネルギーです。イオン化エネルギーが小さい原子ほど、電子を飛ばしやすく陽イオンになりやすく、イオン化エネルギーが大きい原子ほど、電子を弾き飛ばしにくく、陽イオンになりにくくなっています
11.元素と単体
元素と単体の違いを解いてくる問題も定番です。文章から物質を構成している元素のことを言っているのか、単体として存在している物質そのもののことを言っているのか判断していきましょう。
元素と単体の区別方法
元素と単体を区別する方法は、その物質そのものののことを言っているのか、物質の中に含まれている成分のことを言っているのか文脈から判断していくことになります。次の例文を見てください。
- 水は水素と酸素からできている。
- 水を電気分解すると水素と酸素が発生する。
上記の例文の場合、1で書かれている「水素」は、水H2Oの中のHのことを言っていますので、1の水素は元素のことを言っています。
一方、2の例文では水を電気分解して水素と酸素が発生したことを言っています。
2H2O→2H2+O2 この場合の水素はH2という物質そのものを言い表しています。したがって、2の水素は単体のことを言っています。
(a)鉄という単体の物質を食べるはずがないですので、この場合の鉄は色んな栄養素の中のFeという成分のことを言っています。元素。
(b)同素体は、同じ元素からなる単体どうしのことです。赤リンや黄リンは単体を表していますが、それらを構成しているリンという元素のことを言っているので、元素。
(c)塩素の酸化力と臭素の酸化力、つまり、塩素という気体と臭素という液体の酸化力の違いを言っていますので、塩素という気体そのもののことです。単体。
(d)アンモニアNH3を構成している元素Nのことを言っています。元素。
(e)金属ナトリウムNaという物質そのものを言い表いています。金属のナトリウムは水と爆発的に反応します。単体。

コメント