高校化学の有機化学について勉強します。今日は有機化学の最初の山「異性体」について学習します。異性体とは何なのか。どんな種類があるのかをマスターしましょう。
異性体とは?
異性体とは、分子式が同じでも性質が異なる化合物のことをいいます。なぜ分子式が同じでも性質が異なるのかというと、構造式が異なるからです。構造式が異なると物理的・化学的な性質に変化が現れるのです。
異性体と一言で言っても、次のように分類することができます。

構造異性体
有機化合物の中心には炭素Cがあり、この炭素Cによって化合物の骨格がつくられています。骨格となる炭素Cの並び方や、骨格につながる原子や官能基が異なる異性体を「構造異性体」といいます。構造異性体には3つのタイプがあります。
- 炭素Cのつながり方が異なる
- 官能基の種類が異なる
- 官能基の位置が異なる
1.炭素Cのつながり方が異なる
炭素C骨格のつながり方の違いを見るために、炭素Cが4つの場合を考えてみます。この場合、下の図のようにいくつかの炭素Cのつながり方があります。
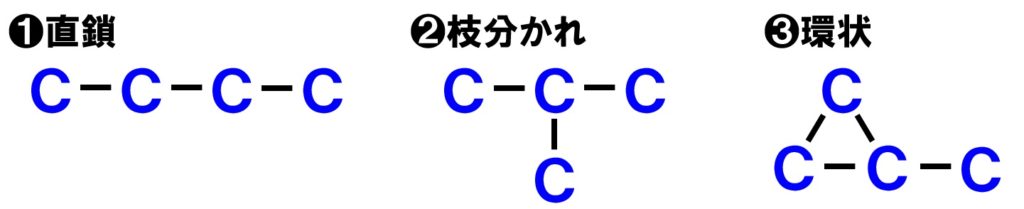
このように、炭素Cのつながり方が異なるパターンが考えられます。
2.官能基の種類が異なる
次は、官能基の種類が異なる場合です。官能基が異なると、分子式が変わってくるのでは?と思う生徒も多いのではないでしょうか。しかし、つぎのような場合は、分子式が同じになります。
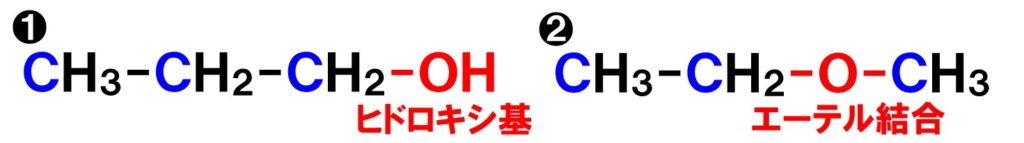
どちらも分子式はC3H8Oになりますが、官能基が異なるので、性質もまったく異なってきます。
3.官能基の位置が異なる
最後は、官能基の種類は同じであっても、官能基が炭素C骨格に結合する部分が異なる場合です。これも分子式はどちらもC3H8Oになります。しかし、構造式や性質は異なります。
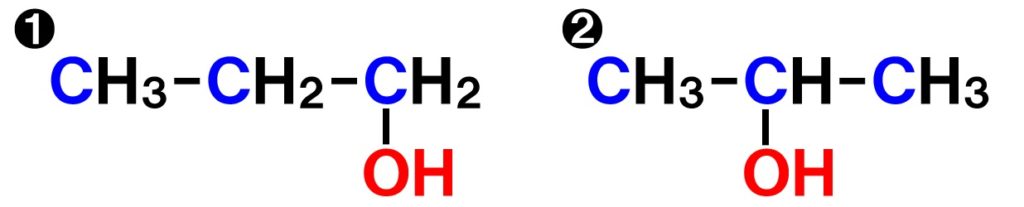
幾何異性体(シス-トランス異性体)
次は立体異性体の中の「幾何異性体」です。立体異性体と呼ばれるだけに、立体的な構造に違いが見られます。幾何異性体は、「シス-トランス異性体」とも呼ばれ、炭素C骨格に二重結合を持つ場合に考えられる異性体構造です。下の図は、どちらも分子式C4H8の化合物です。
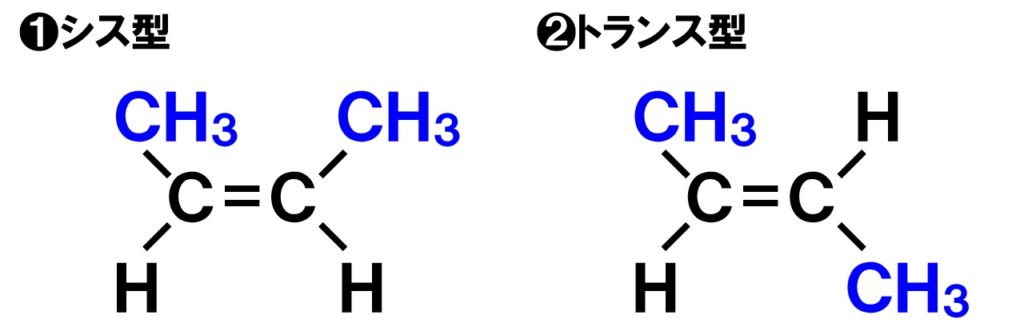
炭素Cの間の結合が単結合の場合、その結合は固定されておらず、自由に回転することができますが、二重結合の場合自由に回転することができません。したがって、上の図の場合、メチル基(CH3)が同じ側にある「シス型」と、対角線上にある「トランス型」の2つの異性体が考えられます。
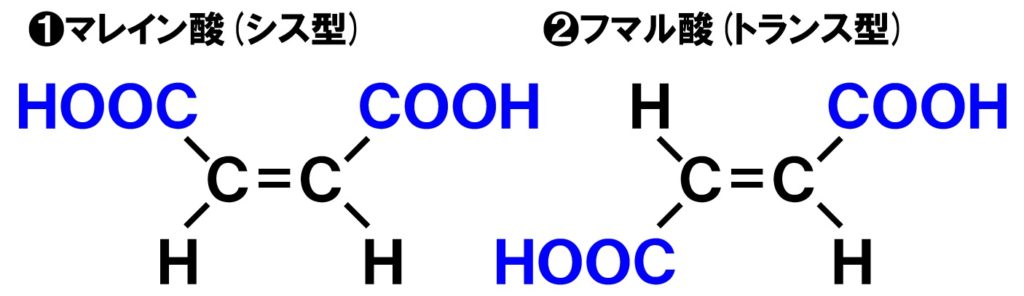
マレイン酸とフマル酸
幾何異性体(シス-トランス異性体)として有名なものに、マレイン酸とフマル酸があります。シス型のマレイン酸よりも、トランス型のフマル酸の方が分子が並びやすい構造になっており、分子間で水素結合が生じやすくなっています。したがって、フマル酸の方が沸点が高いのが特徴です。
光学異性体(鏡像異性体)
光学異性体とは、不斉炭素原子をもつ化合物にある異性体です。不斉炭素原子とは、結合する4つの原子(原子団)が全て異なる炭素原子のことです。この不斉炭素原子をもつ化合物は、鏡に映るものと鏡に映ったものの2つの異性体が存在します。
互いに鏡像体の関係にあるとも言われますので、光学異性体を鏡像異性体とも呼びます。鏡に映った2つの化合物は、空間的に原子(原子団)の配置が異なるため互いに異性体の関係になるのです。下の図は乳酸の構造式です。不斉炭素原子が存在するので、光学異性体の関係にあります。
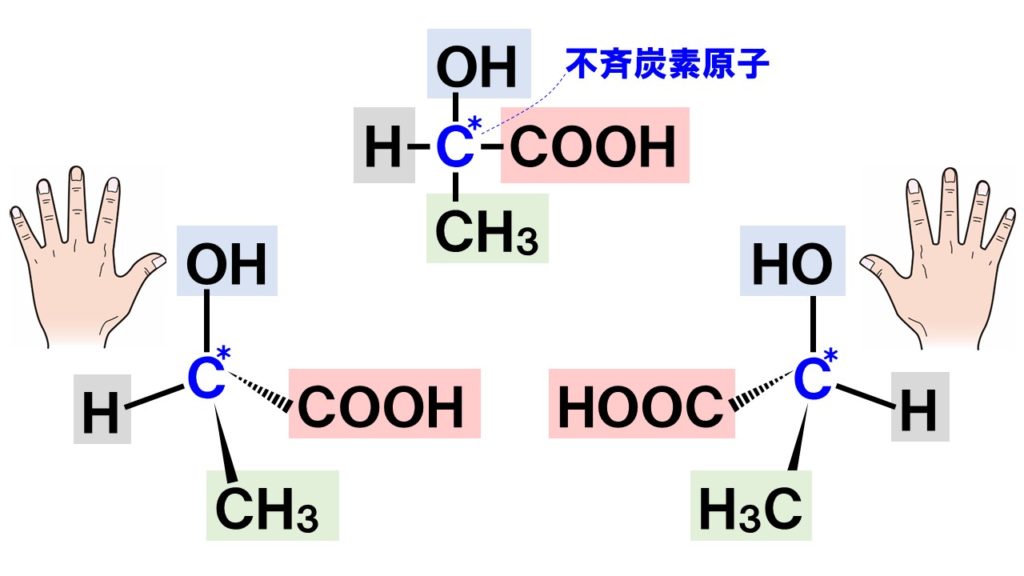
鏡に映るものと鏡に映ったものの関係になることがわかります。もっとわかりやすく言うと、右手と左手のような関係です。親指から小指まで、手についている指は変わりませんが重ねても互いに一致しませんよね。この構造が光学異性体なのです。
旋光性
光学異性体(鏡像異性体)は、沸点・融点等の性質はほとんど変わりありませんが、一定方向に振動する光である平面偏光を回転させる向きが異なります。この性質を旋光性と呼びます。
その他にも、光学異性体(鏡像異性体)には、味やにおいなどが異なるといった違いも見られます。

コメント