【高校化学】物質の状態と平衡「物質の三態」についてまとめています。結合の強さによって沸点や融点がどのように変わるのかがポイントです。
- レベル:★★☆☆☆基礎
- 重要度:★★★☆☆
- 対応:定期テスト・実力テスト・センター試験
状態変化とエネルギー
状態変化は物理変化の一つで、物質の状態が温度や圧力の変化で、固体↔液体↔気体と変化することです。物質をつくる粒子の結合力の違いによって、状態変化するときの温度が異なってきます。
融解と凝固
融解とは、一定圧力のもとで固体を加熱すると、ある温度で固体が解けて液体になる状態変化です。融解が起こる温度を融点といい、純物質の場合、状態変化が終わるまで一定に保たれます。
なぜ、融点が一定に保たれるのかというと、加えたエネルギーが状態変化だけに使われるからです。物質が固体のとき、物質を構成する粒子は規則正しい配列を保って振動しています。この配列を支えている結合を切り離し、粒子が自由に動ける必要にするために熱エネルギーが使われるのです。
凝固とは、融解の逆で、冷却するとある温度で液体が固まり固体になる状態変化です。凝固が始まる温度を凝固点といい、純物質の場合は融点と凝固点は等しくなります。
融解熱
融解熱とは、融点において、固体1molが融解するのに必要な熱量です。固体は規則正しく配列しており、その配列をを支える結合を切り離すために熱エネルギーを必要とします。したがって、融解熱は吸熱になります。
熱化学方程式で表すと次のようになります。
物質A(固)=物質A(液)-QkJ/mol
凝固熱
凝固熱とは、凝固点において、液体1molが凝固するときに放出される熱量です。粒子の運動が液体よりも固体のほうが不活性になるので、その分熱エネルギーが外部に向かって放出されます。したがって、凝固熱は発熱になります。また、純物質の場合、融解熱と凝固熱の大きさは等しくなります。
熱化学方程式で表すと次のようになります。
物質A(液)=物質A(固)+QkJ/mol
蒸発と凝縮
蒸発とは、液体が気体になる状態変化です。蒸発は液体の表面から気体に状態変化することで、沸騰とは液体の内部からも気体に状態変化する現象です。液体が沸騰を始める温度を沸点といい、融点と同じように、状態変化が終わるまで沸点は一定に保たれます。
凝縮とは、蒸発の逆で、気体が液体になる状態変化です。液体が凝縮しはじめる温度を凝縮点といい、純物質の場合、沸点と凝縮点は同じになります。
蒸発熱
蒸発熱とは、液体1molが蒸発するのに必要な熱量です。液体が気体になると、粒子がさらに活発に運動するので、粒子のエネルギーが大きい状態になります。したがって、蒸発熱は吸熱になります。
熱化学方程式で表すと次のようになります。
物質A(液)=物質A(気)-QkJ/mol
凝縮熱
凝縮熱とは、気体1molが凝縮するときに放出する熱量です。気体が液体になると、粒子の運動のようすがおだやかになりエネルギーが小さくなります。その分、外部にエネルギ-を放出するので、凝縮熱は発熱になります。
熱化学方程式で表すと次のようになります。
物質A(気)=物質A(液)+QkJ/mol
状態変化と熱量の計算
状態変化とエネルギーの単元では、熱量の計算問題が出題されます。比熱や融解熱、蒸発熱を上手く使って計算していきましょう。その前にまずは、熱量の求め方を復習しましょう。
熱量
熱量Qは、比熱を使って計算することができます。比熱とは、物質1gを1K(1℃)上昇させるのに必要な熱量のことです。したがって、熱量の公式は次のようになります。
Q=mcΔT
(m:質量[g] c:比熱[J/(g・K)] ΔT:温度変化[K(℃)])
状態変化と熱量の計算問題
[問題]0℃の氷90gを加熱し、すべて100gの水蒸気にするには、何kJの熱量が必要か計算せよ。ただし、水の比熱を4.2J/(g・K)、氷の融解熱を6.0kJ/mol、水の蒸発熱を41kJ/molとし、Hの原子量を1、Oの原子量を16とする。
解答・解説
①氷が水になるときの融解熱、②0℃の水が100℃の水になるときの熱量、③水が水蒸気になるときの蒸発熱をそれぞれ求め、合計すれば求められます。
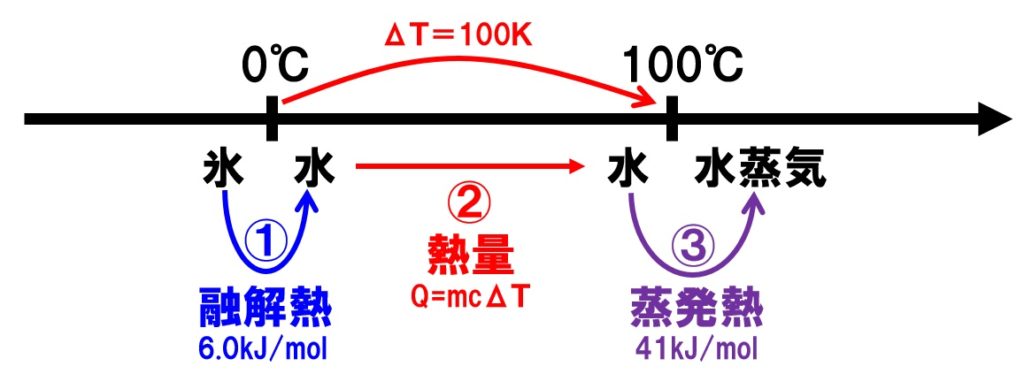
氷(H2O)の分子量は、1×2+16=18 なので、モル質量も18g/molとなる。
氷90gは、90/18=5.0molである。
①の融解熱:6.0kJ/mol×5.0mol=30kJ
②の熱量:90g×4.2J/(g・K)×100K=37800J=37.8kJ
③の蒸発熱:41kJ/mol×5.0mol=205kJ
①+②+③:30kJ+37.8kJ+205kJ=272.8kJ≒2.7×102kJ
状態変化と分子間力
物質は多数の粒子が集まってできています。この粒子の集まり方によって、固体・液体・気体の状態が決まります。粒子間の間には引力がはたらき、粒子が集合しようとする一方で、熱運動によって離散しようともします。この引力と熱運動の大小関係で粒子の集まり方が変わるのです。
分子間力
分子間力とは、分子間にはたらく静電気的な引力です。あとで紹介する、ファンデルワールス力と水素結合をあわせて分子間力といいます。
ファンデルワールス力
ファンデルワールス力とは、すべての分子間にはたらく引力です。電荷の偏りを持った極性分子間にもはたらきますし、電荷の偏りを持たない無極性分子間にもはたらきます。
電荷の偏りを持つ極性分子では、わずかに正の電荷を帯びた部分と、わずかに負の電荷を帯びた部分が弱い静電気的な力で引き合います。電荷の偏りを持たない無極性分子でも、分子内の電子の運動により、瞬間的に電気の偏りを生じ、無極性分子どうしも弱い静電気的な力で引き合うのです。
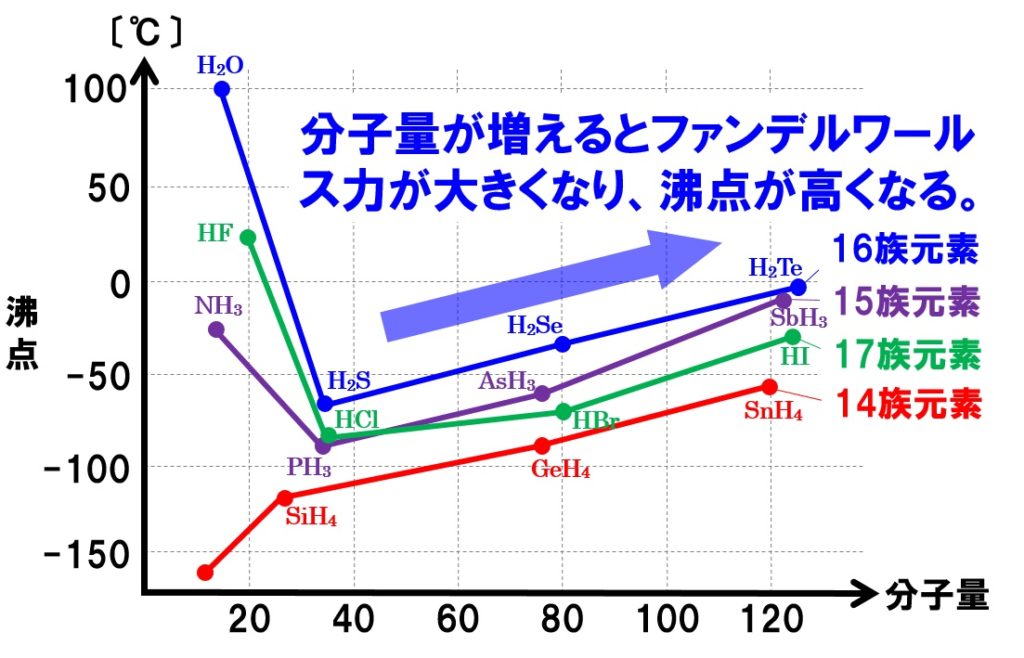
ファンデルワールス力は、分子量が大きくなるほど大きくなります。これは、分子内に多くの電子を含んでいるため、瞬間的な電荷の分布の偏りが大きくなるためです。とりあえず重いものほど大きくなると考えておきましょう。
水素結合
水素結合とは、特に強い極性を持つ分子どうしが引き合う際にできる結合です。電気陰性度が大きい原子であるフッ素Fや酸素Oなどと水素Hが共有結合をすると、強い極性を持った分子ができます。フッ化水素HFを例にとって考えて見ると、電気陰性度が小さい水素原子Hは強く正に帯電し、電気陰性度が大きいフッ素原子Fは強く負に帯電します。この分子内の水素原子Hが仲立ちとなり、隣接する分子のフッ素原子Fと強い静電気的な力で結合するのです。
フッ素原子Fの他にも、酸素原子O、窒素原子Nも電気陰性度が大きい原子なので、水素との化合物である水H2OやアンモニアNH3分子の間にも水素結合が形成されます。
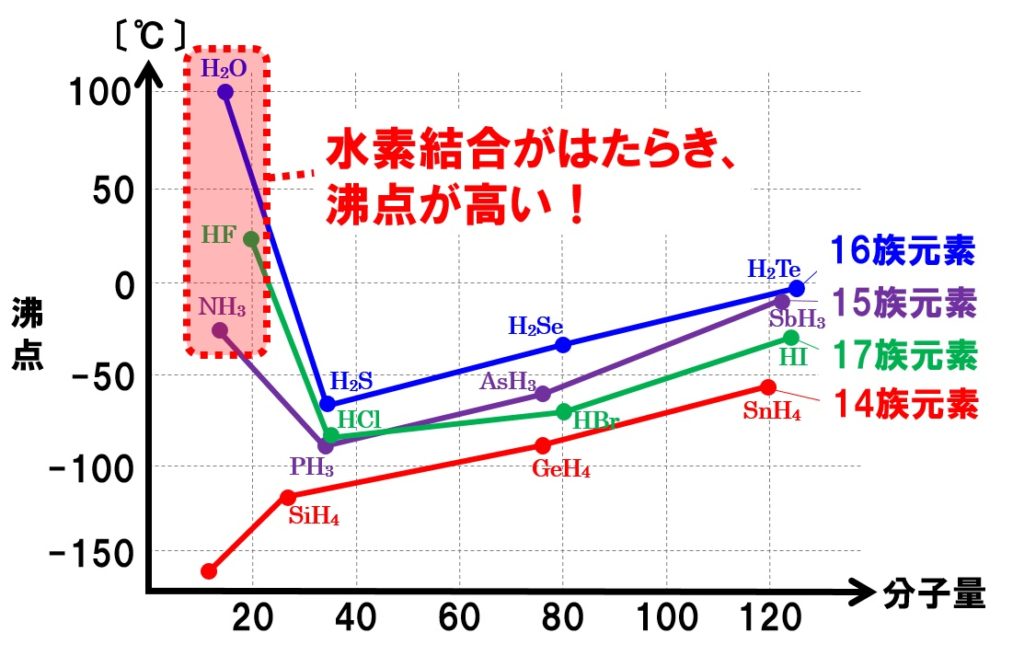
水素結合は、ファンデルワールス力よりも強い結合になるので、水素結合を形成している物質は、ファンデルワールス力だけがはたらいている物質よりも融点や沸点が高くなります。しかし、以前に学習した化学結合である、共有結合やイオン結合、金属結合などと比べると弱い結合になります。
分散力
分散力とは、ファンデルワールス力の中でも、分子の極性によらず、すべての分子間にはたらく引力です。
分子間力と液体の沸点
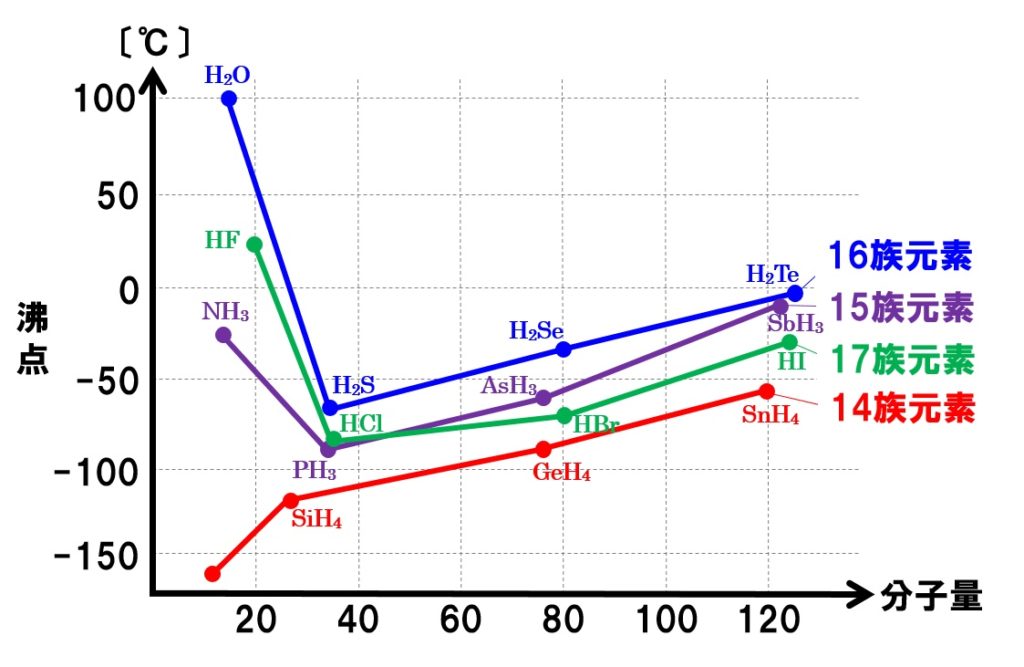
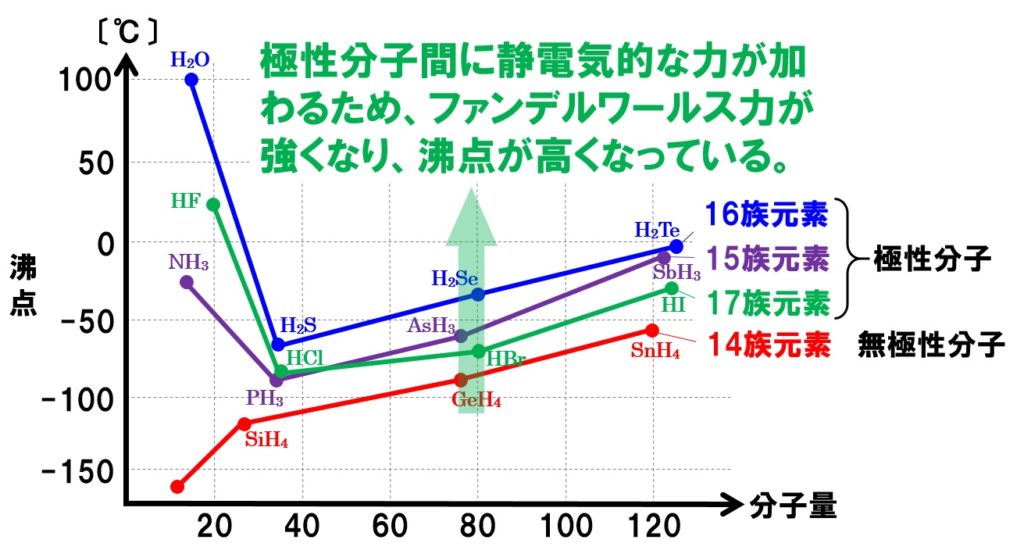
液体が蒸発して気体になるためには、隣接する分子間の分子間力に打ち勝って液体表面から飛び出すだけの熱エネルギーを持つ必要があります。ということは、分子間力が大きいほど、蒸発しにくいと言えるのです。下の図は、水素化合物の分子量と沸点の関係を表したグラフである。大学入試にも頻出のグラフです。
水素結合と沸点
グラフを見てもらえれば分かるように、15族、16族、17族元素の水素化合物の中の水H2O、フッ化水素HF、アンモニアNH3の沸点が分子量が小さいにもかかわらず突出して高くなっていることがわかります。これは、分子間にファンデルワールス力に加えて、それよりも強い水素結合がはたらいているからです。
分子量と沸点
H2OとHF、NH3を除くと、グラフの右側にけば行くほど沸点が上昇していることがわかります。これは、分子量が大きいほど分子間にはたらくファンデルワールス力が大きくなるからです。
分子の極性と沸点
グラフで、分子量が同程度の水素化合物を見てください。14族元素がつくる水素化合物の沸点より、15族、16族、17族元素の水素化合物の沸点のほうが高くなっていることがわかります。これは、14族元素がつくる水素化合物(CH4など)が無極性分子であるのに対して、15族、16族、17族元素がつくる水素化合物は極性分子になります。なので、分子間に静電気的な引力が加わるのです。その分、分子どうしが引き合う力が大きくなり、沸点が上昇するのです。
化学結合と固体の融点
固体が液体に変わる状態変化を融解といいました。物質が融解するには、固体を構成している粒子が、配列を崩し自由に動けるようになるだけの熱エネルギーが必要になります。ということは、粒子間にはたらく化学結合や分子間力などの結合が強いほど固体の融点は高くなり、結合が弱いほど固体の融点は低くなります。
結合の強さは、共有結合やイオン結合のような化学結合が強く、それに対して、水素結合やファンデルワールス力のような分子間力のほうが弱くなります。
結合力の比較
物質を構成する粒子間にはたらく力を強い順に並べると次のようになります。
- 共有結合(化学結合)
- イオン結合(化学結合)
- 金属結合(化学結合)
- 水素結合(分子間力)
- ファンデルワールス力(分子間力)
共有結合
共有結合する物質の中で、ダイヤモンドやケイ素は結合の腕である原子価が4つになり、次々と隣接する原子と共有結合をくりかえします。その結果、共有結合のみで構成される共有結合の結晶を形成しました。この共有結合の結晶は、非常に硬く、融点・沸点も非常に高くなります。
共有結合の結晶をつくる物質は次の4つを覚えておきましょう。
- C ダイヤモンド
- Si ケイ素
- SiO2 二酸化ケイ素
- SiC 炭化ケイ素
イオン結合
イオン結合でできた物質は、陽イオンと陰イオンが強い静電気的な力(クーロン力)で結合している物質です。金属元素が陽イオンに、非金属元素が陰イオンになることが多いので、金属元素と非金属元素で結合している化合物が、イオン結合をしているとも言えます。イオン結合をしている物質はイオン結晶をつくり、硬くて融点・沸点も高くなります。
イオン結合をしてイオン結晶をつくりだす物質は次のようなものです。
- NaCl 塩化ナトリウム
- CuO 酸化銅
- BaSO4 硫酸バリウム
金属結合
金属は、金属原子が次々に最外殻の自由電子を互いに共有しながら結合しています。これを金属結合といいます。物質の中では金属単体がこれに当たります。金属結合を形成している物質は、金属結晶をつくっており、融点・沸点が一般に高いという性質があります。
金属結合をし金属結晶をつくっている物質には次のようなものがあります。
- Fe 鉄
- Cu 銅
- Au 金
- Al アルミニウム
分子間力と沸点に関する問題
[問題]第2~5周期の15族、16族、17族元素の水素化合物は、同程度の分子量をもつ14族元素の水素化合物よりも沸点が高い。中でも、第2周期の15族、16族、17族元素のうち、最も分子量の小さな水素化合物はいずれも強い極性をもつため、それらの沸点は、分子量から予想される値よりも異常に高い。①沸点は、高い方から( a )>( b )>( c )となっている。また、これらの水素化合物における水素結合1つの強さは( d )>( e )>( f )となっている。
(1)( a )~( f )にあてはまる分子式を答えよ。
(2)下線部①について、( a )>( b )となる理由を30字以内で記せ。
解答・解説
(1)a:H2O b:HF c:NH3 d:HF e:H2O f:NH3
H2O、HF、NH3の沸点が異常に高いのは、水素結合が分子間力に加わっているからである。この中で最も沸点が高いのはH2Oで100℃、次いでHF、NH3となる。
水素結合1つの強さは、分子内に含まれる元素の電気陰性度の強さで決まる。電気陰性度はFが4.0、Oが3.4、Nが3.0となっている。
(2)1つの分子当たりの水素結合の数が、水のほうがフッ化水素よりも多いため。
フッ化水素HFは、隣接する分子と1分子当たり2個の水素結合をつくるが、水H2Oは、隣接する分子と1分子当たり4個の水素結合をつくる。


コメント