大学入試化学の有機化学について勉強します。今日は前回に引き続き、異性体について学習します。分子式からどのような異性体が存在するのかを推理していきます。
異性体の見つけ方
前回は異性体の種類について学習しました。異性体には、炭素Cの骨格が違ったり、官能基の種類やくっつく位置によって「構造異性体」というものがありました。また、炭素C骨格に二重結合が見られる場合には「幾何異性体(シスートラン異性体)」という立体異性体が存在したり、「光学異性体(鏡像異性体)」という立体異性体も存在しました。光学異性体は不斉炭素原子がポイントでしたね。今日は、分子式から何種類の異性体が考えられるのか調べていきます。
分子式から不飽和度を求める
分子式から化合物の異性体を考える場合、まずは不飽和度を計算します。
不飽和度とは、分子の中の環の数と二重結合や三重結合の数のことです。不飽和度を調べることによって、その分子中に環が何個あるのか、また炭素C骨格の二重結合や三重結合が何個あるのかが分かります。ですので、異性体を感がる際にはまず不飽和度を求めることから始めてください。
分子式がCxHyOzやCxHyのとき、

不飽和度が0の場合
炭素C骨格は全て単結合からなります。二重結合や三重結合、環構造も見られません。
不飽和度が1の場合
不飽和度が1になった場合には、次のどちらかが考えられます。
- 二重結合(C=CやC=O)が1つある
- 環構造が1つある
不飽和度が2の場合
不飽和度が2になると、考えられる選択肢も広がります。次のどれかが考えられます。
- 三重結合(C≡C)が1つある
- 二重結合(C=CやC=O)が2つある
- 環構造が2つある
- 二重結合が1つと環構造が1つある
不飽和度が4の場合
不飽和度が3になる場合はあまり考えられませんので、次は4になる場合です。この場合はベンゼン環が1つ含まれている場合が多いです。
-
- ベンゼン環が1つある
- 不飽和度が4になるように、三重結合、二重結合、環構造が含まれる
ベンゼン環については後程説明します。
不飽和度を計算して、不飽和度が0になった場合には二重結合も環構造も考えられませんので、構造式の決定が簡単になります。不飽和度が0にならなかった場合や、酸素原子Oが含まれる場合には、考えられる炭素骨格のパターンを書き出した後に、二重結合や酸素原子を考えれる位置に当てはめていく操作が必要になります。
C4H8の分子式で異性体を考えてる
まずは不飽和度の計算です。上の式に当てはめてみると、不飽和度は1になります。不飽和度が0にならなかったので、炭素Cの骨格に二重結合が1つあるか環構造が1つあることになります。
鎖状構造の炭素C骨格パターンを全て書く
例えば、C4H8の分子式の場合、炭素Cが4つの骨格からできているので、考えられる鎖状構造は、
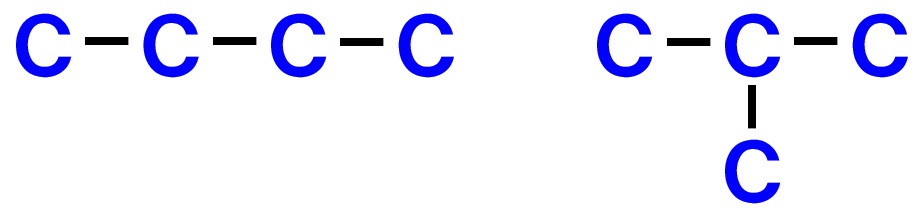
の2通りが考えられます。これを全て書き出しておきます。
二重結合や官能基、環構造を炭素C骨格に当てはめてみる
考えられる鎖の構造が決定したら、C4H8の場合、不飽和度が1でしたので、二重結合が1カ所か、環構造が1つどこかに入ることになります。
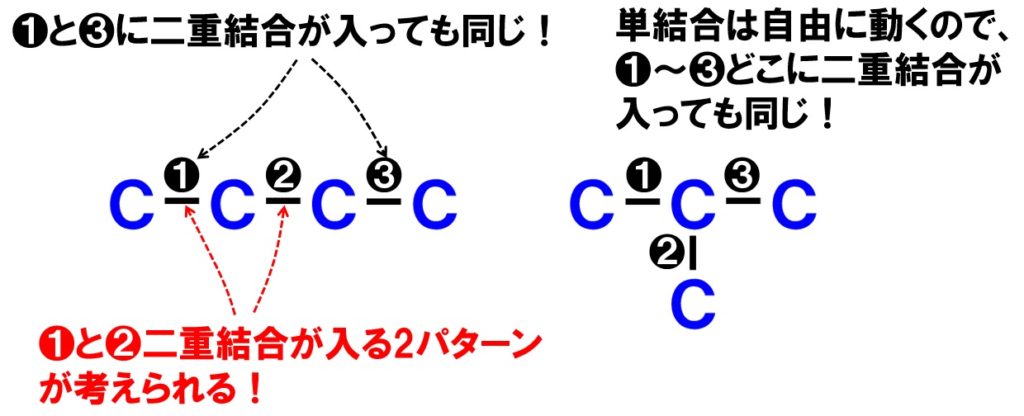
二重結合が入るパターンは上図から3パターンであることがわかります。
環構造が1つ入ることも考えられるます。考えられる環構造は、炭素Cが4つなの次の2つのパターンが考えられます。
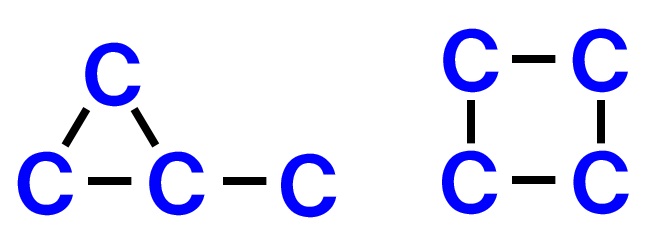
環構造は以上の2パターン考えられます。ここまで合計5パターン考えられます。
幾何異性体や光学異性体がないか検討する
最後に幾何異性体(シス‐トランス異性体)や光学異性体(鏡像異性体)がないか、ここまで考えた異性体すべてを見ていきます。
炭素骨格が直鎖で、中心の炭素間に二重結合がある化合物には幾何異性体(シスートランス異性体)が見られます。
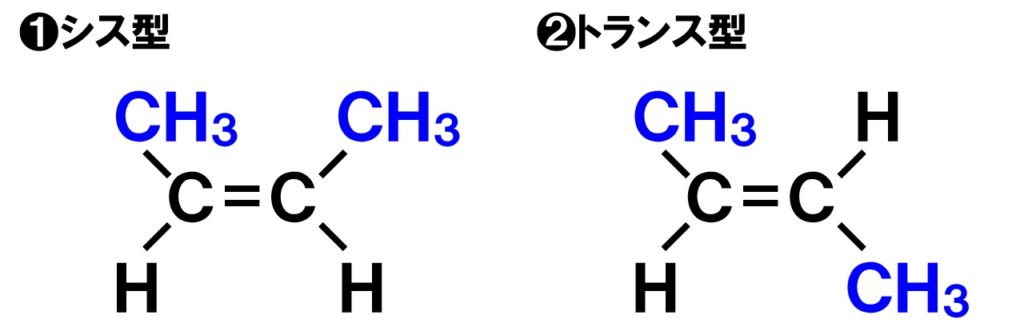
不斉炭素原子はありませんので、光学異性体(鏡像異性体)は存在しませんね。
ここまでの4段階の手順で、異性体を探し出して行くことになります。面倒ですが、数をこなして慣れていくしかありませんね。頑張ってください。

コメント