物質の三態のうち、気体と液体の状態変化に注目してみます。ポイントは気液平衡時の蒸気圧です。また、蒸気圧曲線や状態図の見方もマスターしましょう。
- レベル:★★★☆☆基礎
- 重要度:★★★★☆
- 対応:定期テスト・実力テスト・センター試験
気体の圧力
物質が気体の状態であるとき、気体分子が空間を自由に飛び回り熱運動を行っています。この気体分子が、容器などの壁に衝突し、壁を外側に押す力が気体の圧力の原因となります。ということは、熱運動している気体分子の速さが速いほど、また、一定時間に衝突する気体分子の数が多いほど気体の圧力は大きくなるのです。
圧力の単位 Pa
圧力とは、単位面積1㎡当たりにはたらく力のことで、単位にはPa(パスカル)が使われています。1㎡あたりに何Nの力が加わっているのかを計算すればいいのですから、N/㎡とPaは同じになります。また、100Pa=1hPaであることも覚えておきましょう。
圧力[Pa]=力の大きさ[N]÷ 面積[㎡]
大気圧
大気圧とは、大気(空気)による圧力のことで、海面上(海抜0m)での大気圧は、1.013×105Paになります。この大気圧を1気圧や1atm(アトム)と呼ぶこともあります。
海面上での大気圧=1.013×105Pa=1013hPa=1気圧=1atm
水銀柱による圧力の測定
圧力の表し方に水銀柱の高さを使ったものがあります。一端を閉じた長いガラス管を水銀で満たし、水銀溜めの中に倒立させると、管内の水銀柱は、約760mmの高さで止まります。このとき、水銀溜めの水銀にはたらく大気圧と、760mmの水銀柱にはたらく重力による圧力がつり合っています。
これを利用して、圧力を水銀柱の高さで表すこともでき、高さ1mmの水銀柱の示す圧力を1mmHg(ミリメートル水銀柱)と表します。大気圧とつり合う水銀柱の高さが760mmだったので、1気圧=1.013×105Pa=760mmHgとなります。
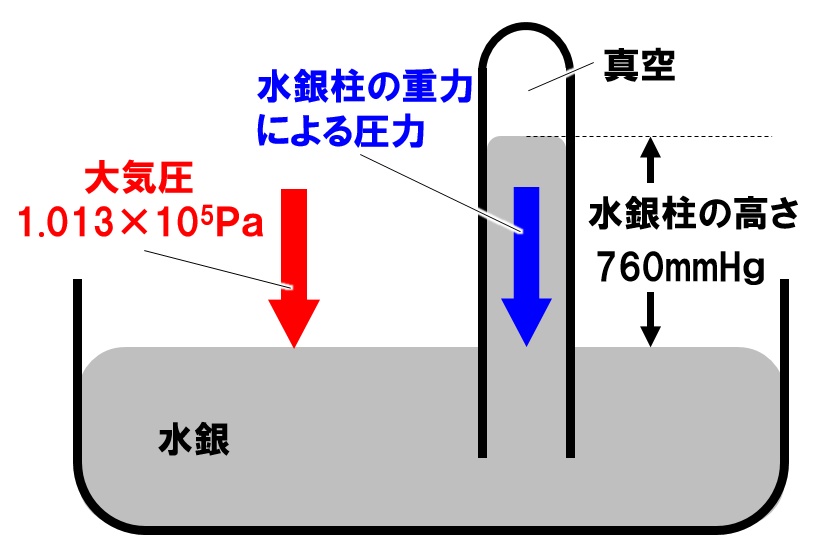
1.013×105Pa=1013hPa=1気圧=1atm=760mmHg
水銀柱による気体の圧力計算
[問題]大気圧が1.013×105Paのとき、下図のように、水銀を満たした試験管内に、ある揮発性の液体を少量入れたところ、その液体は水銀面上ですべて気体となった。このとき、水槽内の水銀面と試験管内の水銀面の高さの差は660mmであった。この気体の圧力は何Paか。
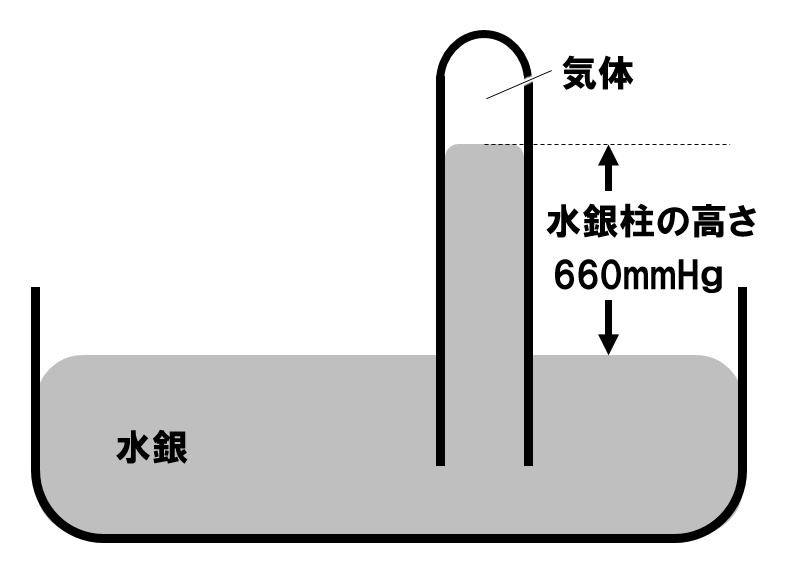
1気圧(1.013×105Pa)での水銀柱の高さは760mmHgなので、
760-660=100mm水銀柱の高さが減少しています。
この減少分は気体の圧力によるものです。次の式が成り立ちます。
1気圧(1.013×105Pa)=水銀柱の圧力+気体の圧力
760mmHg(1気圧)=660mmHg(水銀柱の圧力)+100mmHg(気体の圧力)
したがって、気体の圧力は、
760[mmHg]:100[mmHg]=1.013×105[Pa]:P気体[Pa]
P気体=1.33×104Pa
気液平衡と蒸気圧
液体中の分子が、周囲の分子との間にはたらく引力に打ち勝って、液体の表面から外部に飛び出し気体(蒸気)になる現象が蒸発です。一方、気体(蒸気)中の分子の中には、液体の状態に戻るものも存在します。この現象は凝縮と呼ばれます。
気液平衡
簡単に言うと、液体が蒸発し気体になる量と、気体が凝縮し液体になる量が等しく、見かけ上、蒸発と凝縮が起こっていないように見える状態を気液平衡といいます。
温度を一定に保った密閉容器内に液体を入れて放置すると、最初は液体が蒸発して気体になる量の方が、気体が凝縮して液体になる量よりも多くなります。しかし、一定時間が経過すると、気体が凝縮し液体になる量も増加してくるので、最終的には気液平衡の状態になります。
飽和蒸気圧(蒸気圧)
液体と気体が存在し、気液平衡の状態にあるときの蒸気の圧力を飽和蒸気圧(蒸気圧)といいます。簡単に言うと、液体が蒸発して気体になろうとするときの圧力です。
飽和蒸気圧(蒸気圧)は、物質の種類ごとに決まっており、一定温度のもとでは、液体の量や気体の体積に関係せず一定の値をとります。また、蒸気圧は、他の気体が共存していても変わらないことも覚えておきましょう。
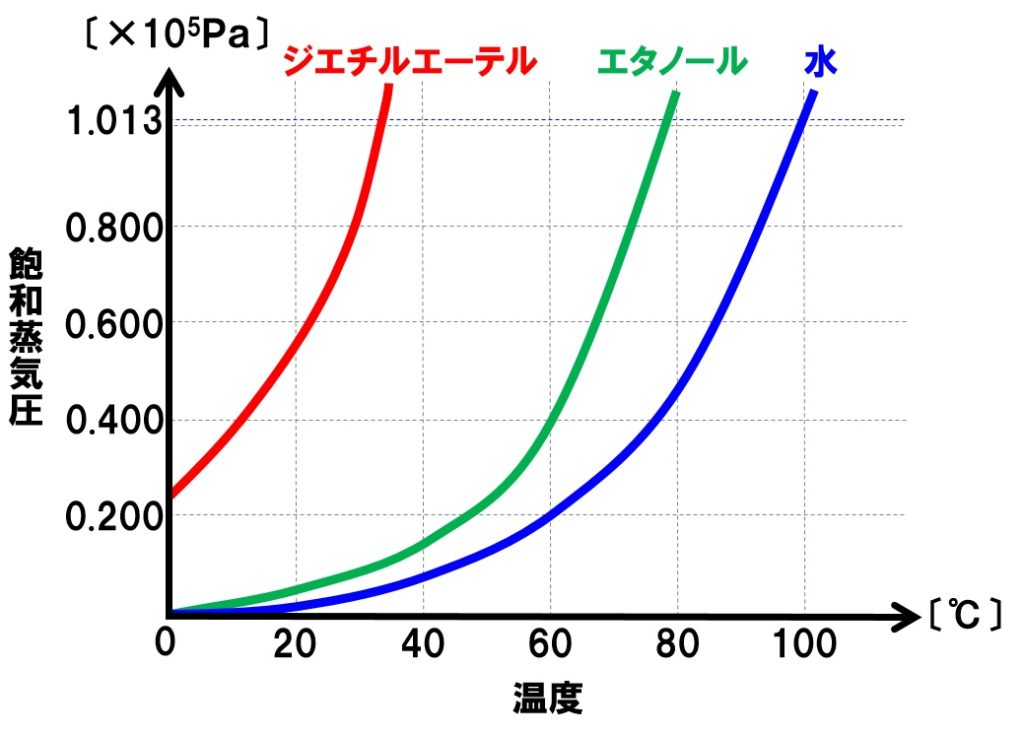
温度が変化した場合、飽和蒸気圧(蒸気圧)は変化します。温度が高くなれば、液体中の分子が持つ運動エネルギーが増加するので、蒸気圧も大きくなります。この温度と蒸気圧の関係をグラフに表したものが蒸気圧曲線です。
沸騰
液体の表面から気体になる現象を蒸発というのに対し、液体の内部からも気体になる現象を沸騰といいます。
一定の大気圧のもとで液体を加熱し、温度を上昇させていくと、温度の上昇とともに蒸気圧も上昇します。蒸気圧がこのときの大気圧と等しくなったとき、液体の表面だけでなく、内部からも気体になる現象が起こります。これが沸騰です。このときの温度を沸点といい、沸騰している間は、沸点は一定になります。
沸騰が起こるとき、蒸気圧と大気圧が等しくなっているので、標高が高い場所など大気圧が小さければ沸点も低くなり、標高が低い場所など大気圧が大きければ沸点は上昇します。
沸騰に関する問題
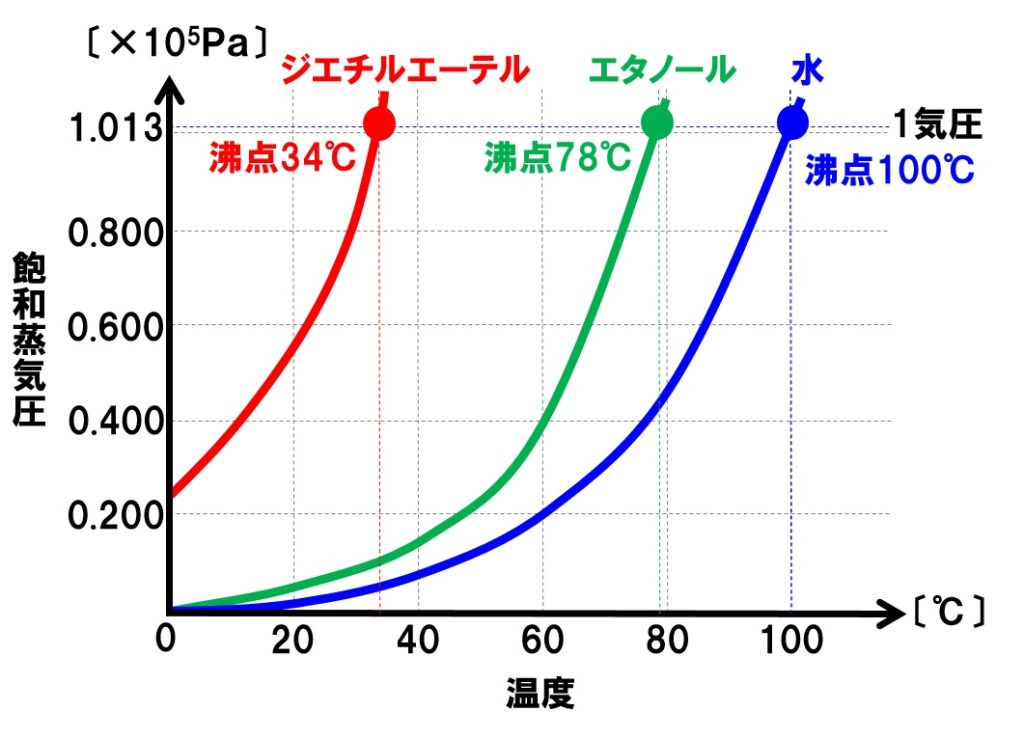
[問題]下の図は、ジエチルエーテル、エタノール、水の蒸気圧曲線を表したものである。次の各問いに答えなさい。

(1)1atmでの沸点が最も低い物質は何か。物質名で答えよ。
(2)上の図で、富士山山頂(大気圧0.600×105Pa)でのエタノールの沸点は約何℃か。
(3)上の図のなかに登場する物質のうち、分子間力が最も大きい物質の化学式を書け。
解答
(1)ジエチルエーテル
1atmとは1気圧のことで、1.013×105Paの圧力になります。蒸気圧もこの圧力と同じになったときに液体が沸騰を始めます。したがって、沸点がいちばん低いのは、グラフよりジエチルエーテルであるとわかります。ジエチルエーテルの沸点は約34℃になります。
(2)約66℃
標高が高い富士山の山頂では、大気圧が0.600×105Paになっているので、エタノールの蒸気圧が0.600×105Paになったときに沸騰が起こります。したがって、この温度は約66℃になります。
(6)H2O
他の物質と異なり、水は分子間に水素結合を生じます。その分、分子間力が大きくなり沸点が高くなります。
状態図
ここまで、物質が温度と圧力の変化により、固体・液体・気体と状態変化するようすを考えてきました。物質が、さまざまな温度と圧力のもとでどのような状態になるのかを表した図が状態図になります。
状態図を見れば、どの温度や圧力の条件下で、物質がどの状態になるのかがわかります。状態図の見方と、それぞれの曲線が何を意味しているのかを掴みましょう。下のグラフは、水の状態図を表したものです。
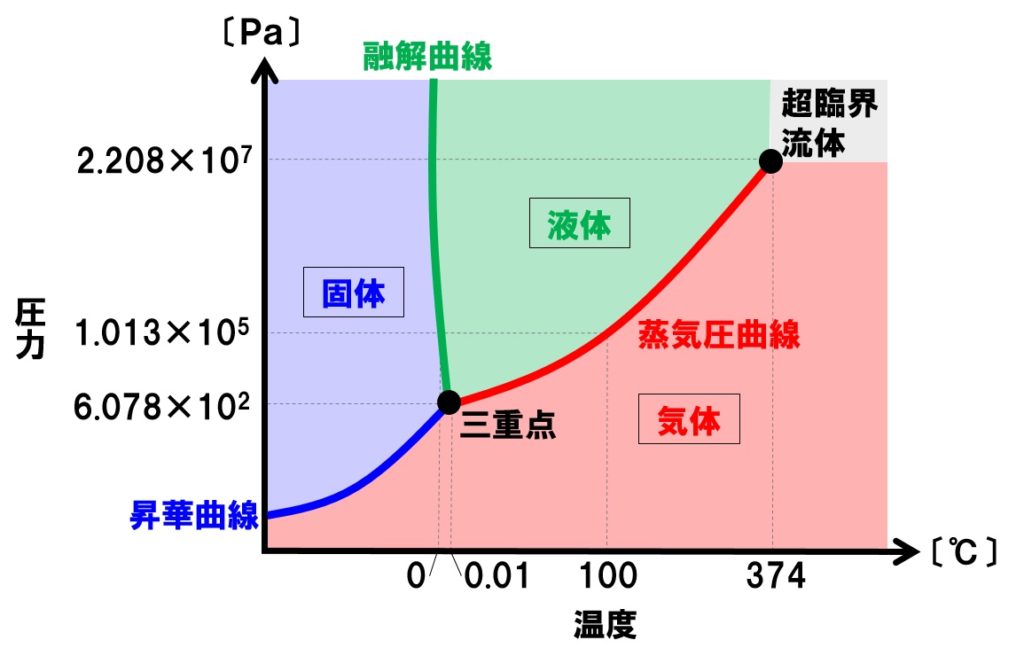
三重点
三重点とは、ちょうど固体と液体と気体の状態の中間点に位置する点です。この温度と圧力の条件下では、固体・液体・気体が共存する特殊な平衡状態になります。
臨界点
温度と圧力を上昇させると、ある温度・圧力の条件下で、物質は液体とも気体とも区別がつかない状態になります。この温度と圧力を臨界点といいます。臨界点に達すると物質は超臨界状態となり、液体とも気体とも区別がつかなくなります。この臨界状態にある物質を超臨界流体とよびます。
状態図に関する問題
[問題]下の図は、水の状態図を表していいる。これについて、以下の各問いに答えなさい。
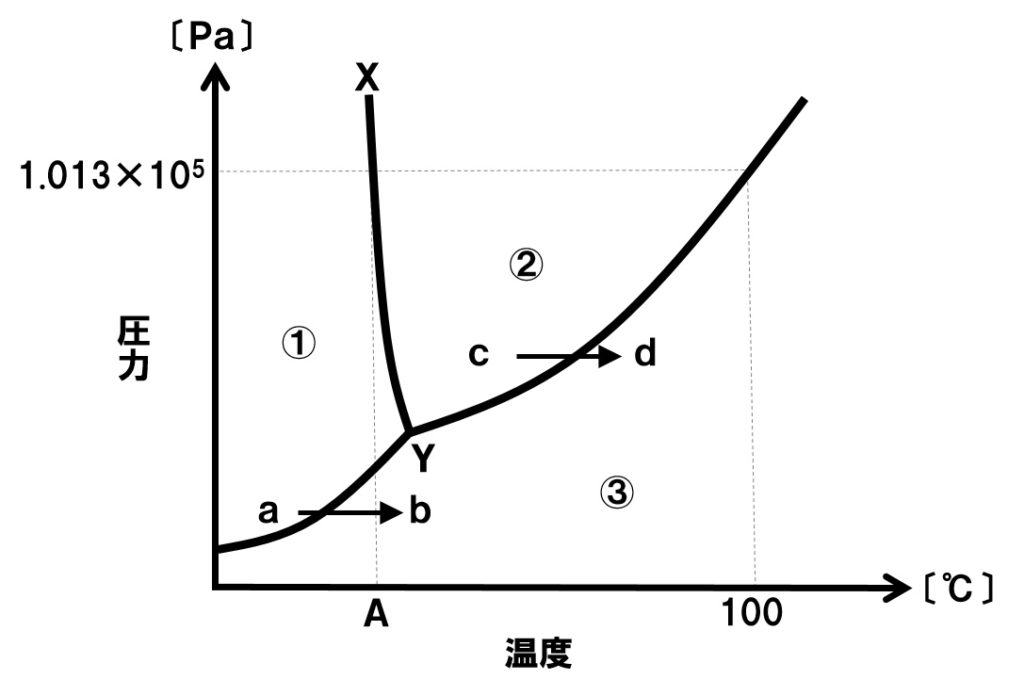
(1)上図の①、②、③の各領域は、水の三態のうち、それぞれどの状態か。
(2)上図の1.013×105PaにおけるAの温度は何℃か。また、その温度の名称を答えよ。
(3)一定圧力下での、図の状態変化a→b、c→dをそれぞれ何というか。
(4)上図の曲線XYを何というか。
解答
(1)①:固体 ②:液体 ③:気体
(2)温度:0℃ 名称:融点
(3)a→b:昇華 c→d:蒸発
(4)融解曲線

コメント