大学入試無機化学。今日はガラスの材料となる炭酸ナトリウムの工業的製法である「アンモニアソーダ法」のポイントを学習して行きましょう。
アンモニアソーダ法とは?
ガラスの原料である炭酸ナトリウムNa2CO3の工業的製法を「アンモニアソーダ法」または「ソルベー法」といいます。まずは全体の流れを押さえて、各反応式が書けるように練習しましょう。
アンモニアソーダ法全体の反応式
- 2NaCl+CaCO3→Na2CO3+CaCl2
アンモニアソーダ法の詳細
次にアンモニアソーダ法を詳しくみていきましょう。投入した原料と最終的な生成物ができるまでの流れを押さえてください。
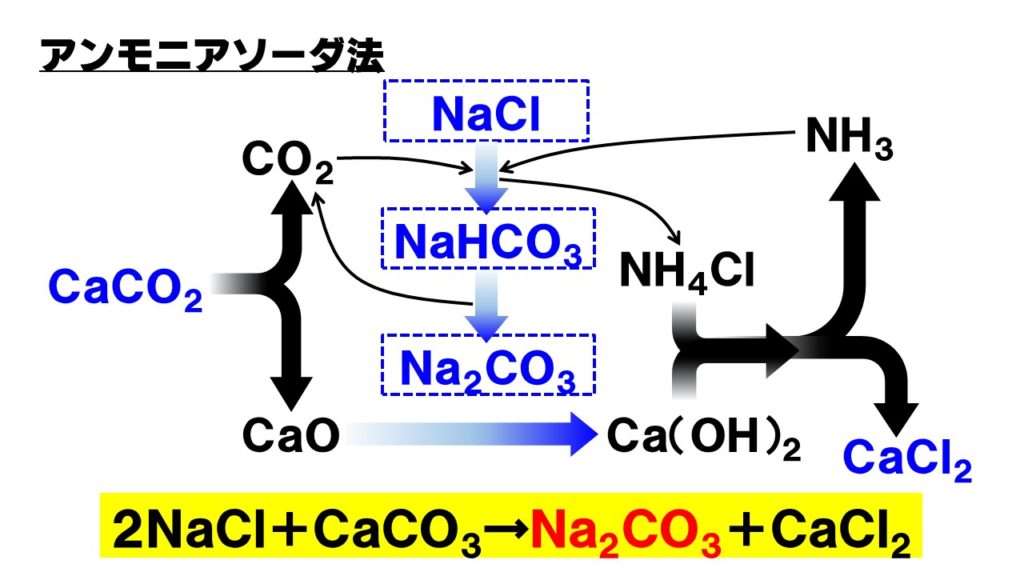
- 塩化ナトリウム飽和水溶液にアンモニアを十分に溶かし、二酸化炭素を吹き込みます。
NaCl+NH3+CO2+H2O→NaHCO3+NH4Cl
塩化アンモニウムNH4Clは塩安とも呼ばれ窒素肥料になる。 - 沈殿で生じた炭酸水素ナトリウムを熱分解する。
2NaHCO3→Na2CO3+CO2+H2O
生じた二酸化炭素は1の反応に利用する。 - 二酸化炭素が足りないので、石灰石(炭酸カルシウム)を熱分解し二酸化炭素を発生させる。
CaCO3→CaO+CO2
生成するCaO酸化カルシウムは生石灰ともいいます。 - 生石灰を水に溶かし水酸化カルシウム(消石灰)にする。
CaO+H2O→Ca(OH)2
生成する水酸化カルシウムは消石灰ともいう。 - 1と4で生じた塩化アンモニウムと消石灰を反応させ、弱塩基の遊離反応を起こす。
2NH4Cl+Ca(OH)2→2NH3+2H2O+CaCl2
生じたアンモニアは1の反応に再利用する。
以上がアンモニアソーダ法(ソルベー法)のまとめです。

コメント