化学の基礎知識を復習していきましょう。まずはイオンに関する内容で、間違いが多い「イオン化エネルギー」と「電子親和力」です。ここはしっかりと定義を覚え、記述できるようになっておきましょう。
イオン化エネルギー
イオン化エネルギーとは、原子から電子を1個とり去って、1価の陽イオンにするのに必要なエネルギーです。特に重要なのが「必要な」というところです。
イメージとして、原子核のまわりを飛んでいる電子を弾き飛ばすというイメージを持っておくとわかりやすいでしょう。
イオン化エネルギーが小さい原子ほど、電子を飛ばしやすく陽イオンになりやすく、イオン化エネルギーが大きい原子ほど、電子を弾き飛ばしにくく、陽イオンになりにくくなっています。
イオン化エネルギーが小さい原子
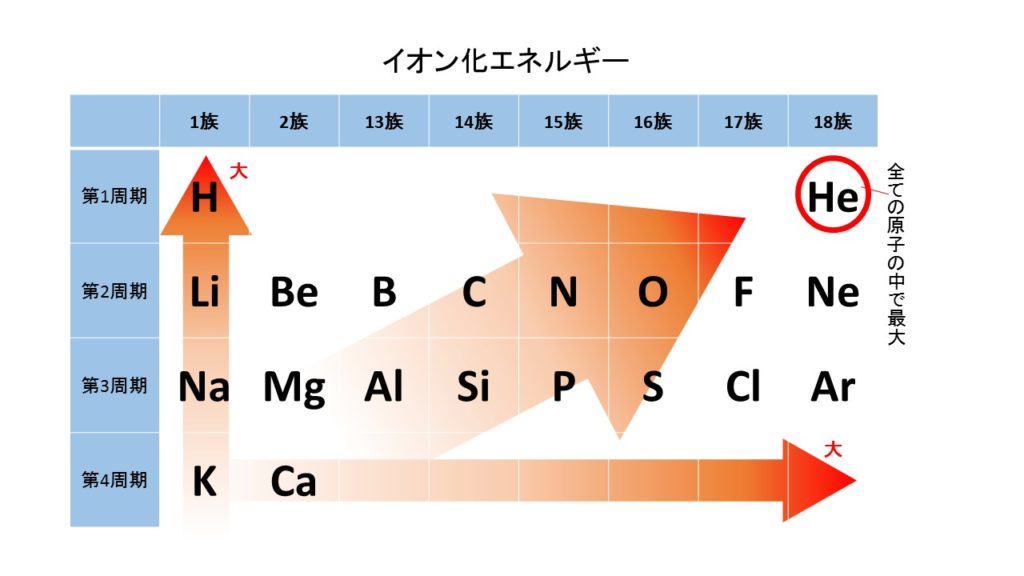
イオン化エネルギーが小さく、最も電子を弾き飛ばしやすい原子は、周期表で言うと最も左側にあるアルカリ金属(1族)になります。アルカリ金属は周期表の同周期内で、最も原子核の正電荷が小さく、電子を引きつける力が弱くなっています。したがって、原子核のまわりを飛んでいる電子を最も弾き飛ばしやすく、陽イオンになりやすい原子だとわかります。
また、周期が増えるほど、周期表で言うと下に行けば行くほど、価電子が原子核から遠ざかり、原子核の正電荷の力が及びにくくなります。したがって、周期が大きければ大きいほどイオン化エネルギーが小さくなり、陽イオンになりやすくなります。
つまり、周期表で一番左下の原子ほど、イオン化エネルギーが小さく、陽イオンになりやすくなります。逆に、周期表の一番右上の原子(He原子)がイオン化エネルギーが大きく、最も陽イオンになりにくい原子だと言えます。
イオン化エネルギーのグラフ
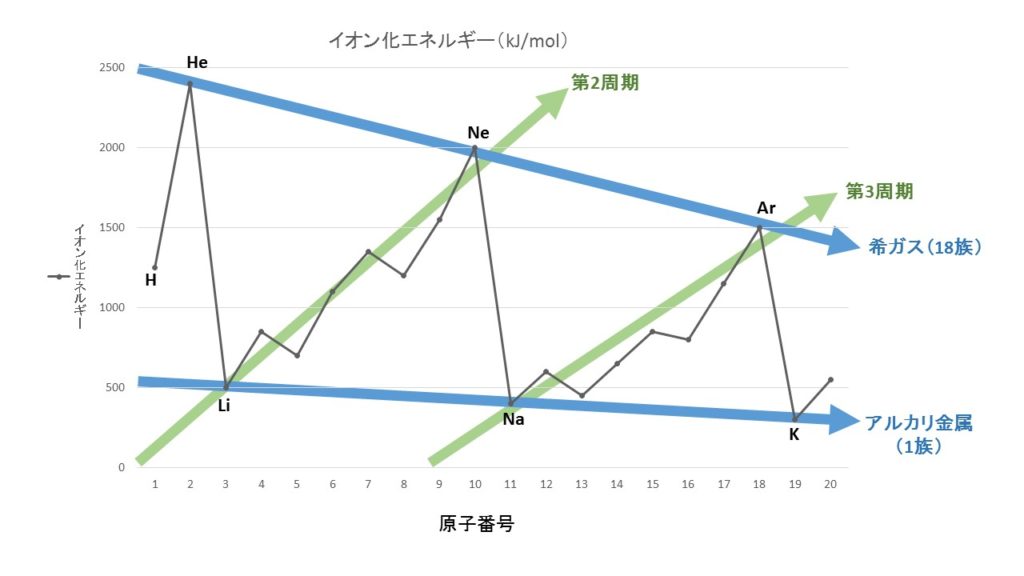
センター試験などで最も出題されやすいのが、イオン化エネルギーのグラフです。しっかりと特徴を捉え、どのグラフがイオン化エネルギーを表しているグラフなのかがわかるようにしておきましょう。
電子親和力
電子親和力とは、原子が電子を1個受け取って、1価の陰イオンになるときに放出されるエネルギーです。イオン化エネルギーでは「必要な」エネルギーでしたが、電子親和力では「放出される」エネルギーとなっていることに注意しましょう。
イメージとしては、地球に隕石が落下するようなイメージを持っておくとわかりやすいのではないでしょうか。原子核の正電荷が大きければ大きいほど電子を隕石のように引きつける力が大きく、地球に隕石が衝突するように、電子が電子殻に入り、エネルギーが発生するのです。
電子親和力が大きな原子ほど、陰イオンになりやすく、電子親和力が小さな原子ほど陰イオンになりにくいです。
電子親和力が大きな原子
ハロゲン(17族)が最も電子親和力が大きく、最も陰イオンになりやすい原子になります。電子親和力が最も大きな原子はF(フッ素)のように考えがちですが、実はCl(塩素)が最大であることも覚えておきましょう。
電子親和力のグラフ
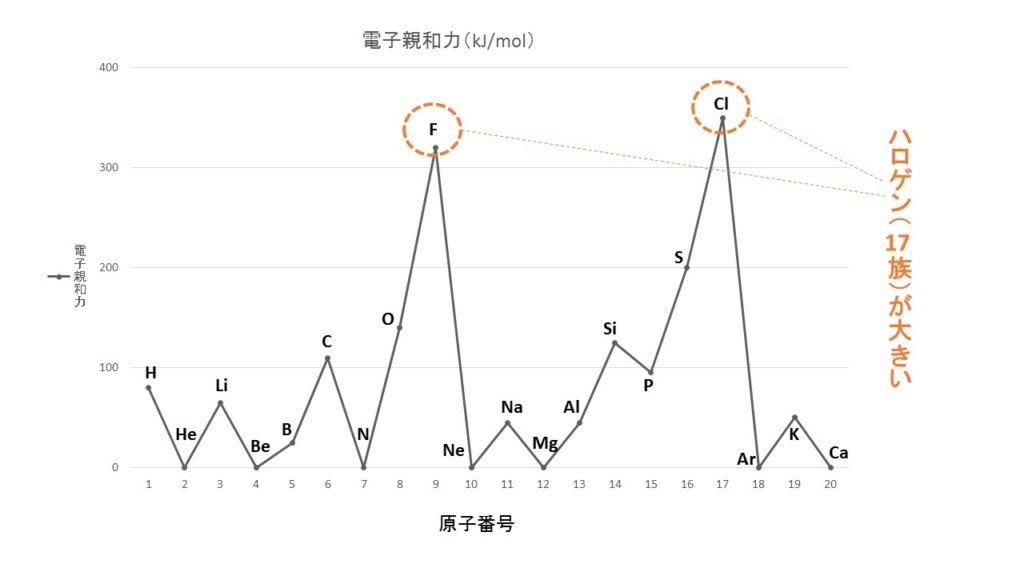
電子親和力のグラフは、イオン化エネルギーのグラフのように大きな特徴があまりありません。ハロゲン(17族)の電子親和力が突出して大きいぐらいです。このグラフもよく出題されますので、見た瞬間電子親和力のグラフだとわかるようにしておきましょう。
【問題】イオン化エネルギーと電子親和力の練習問題
次の文章はイオン化エネルギーと電子親和力について述べたものである。文中の( )に適する語を入れよ。
解答①陽 ②必要 ③ヘリウム ④陰 ⑤放出 ⑥17

コメント
分かりやすい!
ここまで分かりやすいサイトは見たことない!
電子親和力のところが本当に分からなかったので、助かりました!!