原子の構造を学習します。原子を構成する粒子を図で確認し、原子番号や質量数などの見方をマスターします。同位体についても詳しく見ていきましょう。
原子の構造
中学校でも学習したかと思いますが、再度、原子の構造をしっかりと確認しましょう。
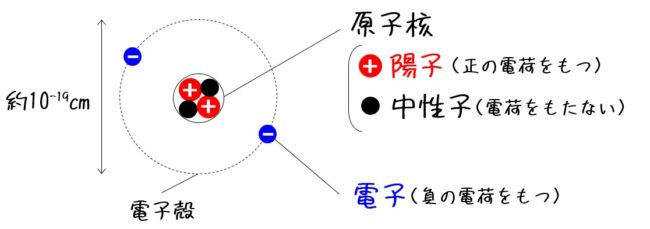
原子の中心には原子核があり、その周りを電子が飛んでいます。原子核の中には、陽子と中性子があります。陽子は正電荷、つまり+の電気を帯びており、電子は負電荷、-の電気を帯びています。
原子は電気的に中性
また、原子では必ず陽子の数と電子の数が一致し、陽子1個が持つ+の電気の量と電子1個が持つ-の電気の量が等しいので、原子全体では電気を帯びていない状態になっています。原子は電気的に中性といわれるのはこのためです。
ちなみに、陽子や電子1個が持つ電気の量を電気素量といいます。その大きさは1.602×10-19C(クーロン)になっています。
陽子・中性子・電子の質量
陽子や中性子、電子の質量は非常に小さいです。なので、相対的に電子1個の質量を1とすると、陽子の質量は1840、中性子の質量も1840になります。つまり、陽子や中性子の質量と比べると、電子は非常に質量が小さいということですね。
原子番号と質量数
次は、原子番号と質量数についてみていきます。原子番号は原子それぞれにつけられた番号で、その原子の陽子の数と一致します。つまり、陽子の数で原子番号が決まり、原子の種類が決まるのです。原子番号2番のHe(ヘリウム)で確認しましょう。
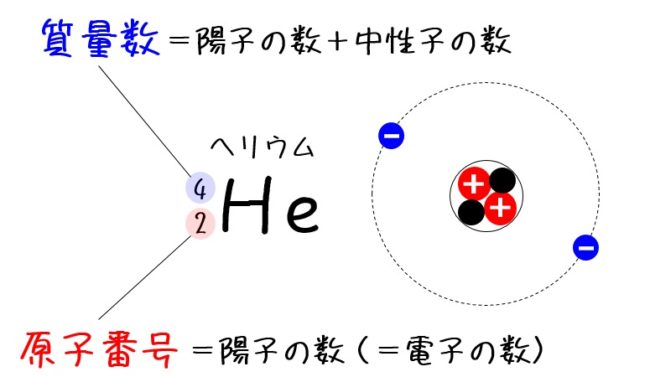
- 原子番号…元素記号の左下に書かれた数字
陽子の数が原子番号。原子では陽子の数と電子の数が一致するので、
原子番号=陽子数=電子数
となる。 - 質量数…元素記号の左上に書かれた数字
質量数は、原子の相対的な重さのようなもの。電子の質量は陽子や中性子と比べて非常に小さいため、陽子の数と中性子の数で決まる。
質量数=陽子数+中性子数
ここで、原子番号や質量数について、練習してみましょう。下の表を埋めてみてください。
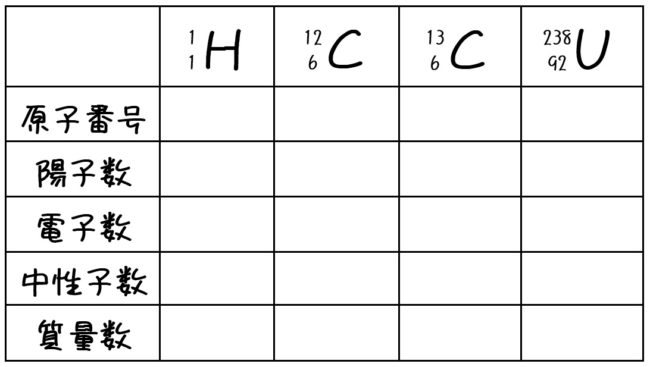
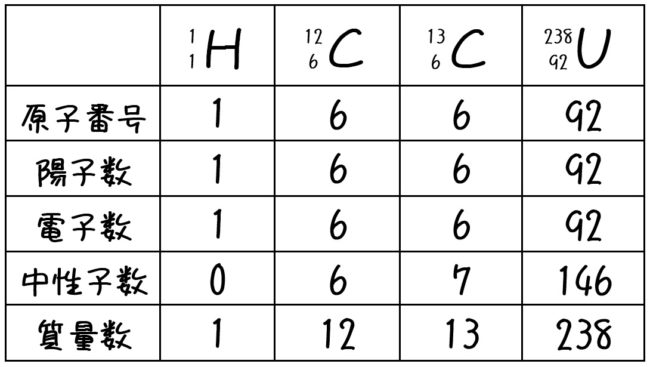
原子番号=陽子数=電子数、質量数=陽子数+中性子数でしたね。
原子の構造の練習問題
Q:次の文中の( )に適する語句や数字を記入しなさい。
原子は原子核と( ① )からできており、原子核は正の電気を帯びた( ② )と電気を帯びていない( ③ )からできている。(②)の数を( ④ )といい、元素記号の左下に添字して表す。また、(②)と(③)の粒子の和を( ⑤ )といい、元素記号の左上に添字して表す。例えば、原子番号8番の酸素原子Oで、質量数が18の場合、(①)の数は( ⑥ )、(②)の数は( ⑦ )、(③)の数は( ⑧ )となる。
原子の構造の練習問題 解答
A
原子は原子核と(①電子)からできており、原子核は正の電気を帯びた(②陽子)と電気を帯びていない(③中性子)からできている。陽子の数を(④原子番号)といい、元素記号の左下に添字して表す。また、陽子と中性子の粒子の和を(⑤質量数)といい、元素記号の左上に添字して表す。例えば、原子番号8番の酸素原子Oで、質量数が18の場合、電子の数は(⑥8)、陽子の数は(⑦8)、中性子の数は(⑧10)となる。

コメント